| –Ъ–Њ–љ—В—А–Њ–ї—М –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –≤ —Е–Њ–і–µ —А–Њ—Б—В–∞ | |
| –Э–Њ–≤–Њ—Б—В–Є –Є —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є - –Э–∞–љ–Њ–Љ–∞—В–µ—А–Є–∞–ї—Л |
|
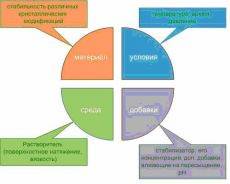
–Э–∞–љ–Њ—З–∞—Б—В–Є—Ж—Л —Б–ї–Њ–ґ–љ–Њ–є –≥–µ–Њ–Љ–µ—В—А–Є–Є –Ј–∞—З–∞—Б—В—Г—О –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М —Б–≤–Њ–є—Б—В–≤ –Њ—В —Д–Њ—А–Љ—Л. –Ґ–∞–Ї–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Є–љ—В–µ—А–µ—Б–љ–∞ –і–ї—П –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ—А–Є–ї–Њ–ґ–µ–љ–Є–є –≤ –Њ–њ—В–Є–Ї–µ, —Н–ї–µ–Ї—В—А–Њ–љ–Є–Ї–µ, –±–Є–Њ–ї–Њ–≥–Є–Є, –Љ–µ–і–Є—Ж–Є–љ–µ, –Ї–∞—В–∞–ї–Є–Ј–µ –Є –њ—А–Є —Б–Њ–Ј–і–∞–љ–Є–Є –Ї–Њ–љ–≤–µ—А—В–µ—А–Њ–≤ —Н–љ–µ—А–≥–Є–Є. –Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –Є–Ј–≤–µ—Б—В–љ–Њ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ–і—Е–Њ–і–Њ–≤ –Ї –њ–Њ–ї—Г—З–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ —Б –Ј–∞–і–∞–љ–љ–Њ–є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–µ–є –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж. –†—П–і –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ —В–∞–Ї–Є—Е, –Ї–∞–Ї —В–µ—В—А–∞–≥–µ–Ї—Б–∞—Н–і—А—Л Pt, –љ–∞–љ–Њ—В—А—Г–±–Ї–Є Nb2O5, —Б–≤–µ—А—Е—А–µ—И–µ—В–Ї–Є CdS-Ag2S, –њ–Њ—А–Є—Б—В—Л–µ —Б—Д–µ—А—Л CuO, –Љ–Њ–љ–Њ–Ї—А–Є—Б—В–∞–ї–ї—Л TiO2, –љ–∞–љ–Њ–њ–∞–ї–Њ—З–Ї–Є LiNbO3 –Є –і—А—Г–≥–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Љ–∞—В–µ—А–Є–∞–ї—Л —Б –љ–Њ–≤–Њ–є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–µ–є –±—Л–ї–Є —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ—Л —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Є–Ї. –Я–Њ–љ–Є–Љ–∞–љ–Є–µ –њ—А–Є—З–Є–љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є –≤ —Е–Њ–і–µ –Ї—А–Є—Б—В–∞–ї–ї–Є–Ј–∞—Ж–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–ї—П –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є—П –±–Њ–ї–µ–µ —В–Њ–љ–Ї–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П —А–∞–Ј–Љ–µ—А–∞, —Д–Њ—А–Љ—Л –Є —Б–≤–Њ–є—Б—В–≤ –љ–∞–љ–Њ–Ї—А–Є—Б—В–∞–ї–ї–Њ–≤, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –Ї—А–∞–є–љ–µ –≤–∞–ґ–љ—Л–Љ –і–ї—П —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –і–Є–Ј–∞–є–љ–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Н–≤–Њ–ї—О—Ж–Є—П –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ —Б—В—А–µ–Љ–ї–µ–љ–Є–µ–Љ —З–∞—Б—В–Є—Ж –Ї –Љ–Є–љ–Є–Љ–Є–Ј–∞—Ж–Є–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–є —Н–љ–µ—А–≥–Є–Є –ї–Є–±–Њ –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —Г—Б–ї–Њ–≤–Є—П–Љ–Є —А–Њ—Б—В–∞. –Т –њ–µ—А–≤–Њ–Љ —Б–ї—Г—З–∞–µ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є —Г—Б—В–Њ–є—З–Є–≤–∞—П —Д–Њ—А–Љ–∞ –Ї—А–Є—Б—В–∞–ї–ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–µ–і—Б–Ї–∞–Ј–∞–љ–∞ —В–µ–Њ—А–Є–µ–є —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б–≤—П–Ј–Є. –Т–Њ –≤—В–Њ—А–Њ–Љ —Б–ї—Г—З–∞–µ —А–∞–Ј–ї–Є—З–љ—Л–µ –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞, pH, –Я–Р–Т, –≤—А–µ–Љ—П —А–µ–∞–Ї—Ж–Є–Є –Є —Б—В–µ–њ–µ–љ—М –њ–µ—А–µ—Б—Л—Й–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —Д–Њ—А–Љ—Г –Ї—А–Є—Б—В–∞–ї–ї–∞. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –і–Њ–±–∞–≤–Њ–Ї –і–ї—П –Ї–Њ–љ—В—А–Њ–ї—П –њ—А–Њ—Ж–µ—Б—Б–∞ —А–Њ—Б—В–∞ —И–Є—А–Њ–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–Њ—Б—М –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л. –Я—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М, —З—В–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –≤–ї–Є—П–љ–Є—П –і–Њ–±–∞–≤–Њ–Ї –љ–∞ –Љ–µ—Е–∞–љ–Є–Ј–Љ –Ї—А–Є—Б—В–∞–ї–ї–Є–Ј–∞—Ж–Є–Є —П–≤–ї—П–µ—В—Б—П –Є—Е —Б–µ–ї–µ–Ї—В–Є–≤–љ–∞—П –∞–і—Б–Њ—А–±—Ж–Є—П –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї—А–Є—Б—В–∞–ї–ї–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –≥—А–∞–љ—П—Е —З–∞—Б—В–Є—Ж, –њ—А–Є–≤–Њ–і—П—Й–∞—П –Ї –≤—Л–і–µ–ї–µ–љ–љ–Њ–Љ—Г —А–Њ—Б—В—Г. –Я–Њ–і–±–Є—А–∞—П —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А—Л, –Њ–±—А–∞–Ј—Г—О—Й–Є–µ —Б–≤—П–Ј—М –ї–Є—И—М —Б –Њ–і–љ–Є–Љ —В–Є–њ–Њ–Љ –∞—В–Њ–Љ–Њ–≤ –≤ –±–Є–љ–∞—А–љ—Л—Е –Ї—А–Є—Б—В–∞–ї–ї–∞—Е, –Љ–Њ–ґ–љ–Њ –≤ —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –њ–∞—Б—Б–Є–≤–Є—А–Њ–≤–∞—В—М —В–µ –Є–ї–Є –Є–љ—Л–µ –≥—А–∞–љ–Є. –Т –Њ–њ–Є—Б—Л–≤–∞–µ–Љ—Л—Е —А–∞–±–Њ—В–∞—Е —В–∞–Ї–∞—П –Љ–µ—В–Њ–і–Њ–ї–Њ–≥–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –Њ—Б—Г—Й–µ—Б—В–≤–Є—В—М –Ї–Њ–љ—В—А–Њ–ї—М —Д–Њ—А–Љ—Л –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ Cu2O, ZnO –Є Fe2O3 –Є –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–∞ –љ–∞ –і—А—Г–≥–Є–µ –Љ–∞—В–µ—А–Є–∞–ї—Л. –°—Г—Й–µ—Б—В–≤—Г—О—В —В–∞–Ї–ґ–µ –Є –і—А—Г–≥–Є–µ –њ–Њ–і—Е–Њ–і—Л –Ї –і–Є–Ј–∞–є–љ—Г –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –≤ —Е–Њ–і–µ —Б–Є–љ—В–µ–Ј–∞, –Є—Б–њ–Њ–ї—М–Ј—Г—О—Й–Є–µ –Ї–∞–Ї —Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ, —В–∞–Ї –Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л –Ї–Њ–љ—В—А–Њ–ї—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є—Е –≤ —Б–Є—Б—В–µ–Љ–µ. 1 –§–∞–Ї—В–Њ—А—Л, –≤–ї–Є—П—О—Й–Є–µ –љ–∞ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—О –Ї—А–Є—Б—В–∞–ї–ї–∞ –Э–∞ –Ї–Є–љ–µ—В–Є–Ї—Г —А–Њ—Б—В–∞ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є–µ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤. –Т—Б–µ –Њ–љ–Є –Љ–Њ–≥—Г—В –±—Л—В—М —Г—Б–ї–Њ–≤–љ–Њ —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 4 –≥—А—Г–њ–њ—Л: —Б–≤–Њ–є—Б—В–≤–∞ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Б–∞–Љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, –Є–Ј –Ї–Њ—В–Њ—А–Њ–≥–Њ —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –Ї—А–Є—Б—В–∞–ї–ї; —Б–≤–Њ–є—Б—В–≤–∞ —А–Њ—Б—В–Њ–≤–Њ–є —Б—А–µ–і—Л; —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ —Г—Б–ї–Њ–≤–Є—П —Б–Є–љ—В–µ–Ј–∞; –і–Њ–±–∞–≤–Ї–Є, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–µ –≤ —Б–Є—Б—В–µ–Љ–µ –Є –Є–Ј–Љ–µ–љ—П—О—Й–Є–µ —Г—Б–ї–Њ–≤–Є—П —А–Њ—Б—В–∞ (—А–Є—Б.1). 2 –°–µ–ї–µ–Ї—В–Є–≤–љ–∞—П –њ–∞—Б—Б–Є–≤–∞—Ж–Є—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї—А–Є—Б—В–∞–ї–ї–∞ –≤ —Е–Њ–і–µ —А–Њ—Б—В–∞ –Ю–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–µ–≥—Г–ї–Є—А–Њ–≤–∞–љ–Є—П –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є –Ї—А–Є—Б—В–∞–ї–ї–∞ —П–≤–ї—П–µ—В—Б—П –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М —Б–Ї–Њ—А–Њ—Б—В–µ–є —А–Њ—Б—В–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А–∞–љ–µ–є. –≠—В–Њ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –њ—Г—В–µ–Љ –њ–∞—Б—Б–Є–≤–∞—Ж–Є–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–µ–є –Ї—А–Є—Б—В–∞–ї–ї–∞ –≤ —Е–Њ–і–µ —А–Њ—Б—В–∞. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —В–∞–Ї–Њ–є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–є –њ–∞—Б—Б–Є–≤–∞—Ж–Є–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –Њ—В–ї–Є—З–Є–µ–Љ –≤ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ —Б–Њ—Б—В–∞–≤–µ —А–∞–Ј–љ—Л—Е –Ї—А–Є—Б—В–∞–ї–ї–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –њ–ї–Њ—Б–Ї–Њ—Б—В–µ–є. –Р–љ–Є–Ј–Њ—В—А–Њ–њ–Є—П –Ї—А–Є—Б—В–∞–ї–ї–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–є –Ї—А–Є—Б—В–∞–ї–ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–Њ–Ј–і–∞–≤–∞—В—М —А–∞–Ј–ї–Є—З–љ—Г—О –њ–ї–Њ—В–љ–Њ—Б—В—М –Љ–Њ–ї–µ–Ї—Г–ї —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А–∞ –Є –Њ–±–Њ—А–≤–∞–љ–љ—Л—Е —Б–≤—П–Ј–µ–є –≤–і–Њ–ї—М —Н—В–Є—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–є. –Ґ–∞–Ї–Њ–є –Ї–Њ–љ—В—А–Њ–ї—М –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ –ї–Є—И—М –љ–∞ —Б–ї–Њ–ґ–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є—П—Е, –≤ –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –њ–Њ–ї—П—А–љ—Л–µ –≥—А–∞–љ–Є, –Њ–±–Њ–≥–∞—Й–µ–љ–љ—Л–µ –Ї–∞—В–Є–Њ–љ–∞–Љ–Є –Є–ї–Є –∞–љ–Є–Њ–љ–∞–Љ–Є. –Я—А–Є–Љ–µ—А–Њ–Љ —В–∞–Ї–Њ–≥–Њ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –Њ–Ї—Б–Є–і –Љ–µ–і–Є (I). 2.1 –Ю–Ї—Б–Є–і –Љ–µ–і–Є –Ъ–∞–Ї –≤–∞–ґ–љ—Л–є –њ–Њ–ї—Г–њ—А–Њ–≤–Њ–і–љ–Є–Ї p-—В–Є–њ–∞ Cu2O –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ —Б–Њ–ї–љ–µ—З–љ–Њ–є —Н–љ–µ—А–≥–µ—В–Є–Ї–µ, –Љ–Є–Ї—А–Њ - –Є –љ–∞–љ–Њ—Н–ї–µ–Ї—В—А–Њ–љ–Є–Ї–µ, –Љ–∞–≥–љ–Є—В–љ—Л—Е —Г—Б—В—А–Њ–є—Б—В–≤–∞—Е —Е—А–∞–љ–µ–љ–Є—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є. –Ф–ї—П –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ Cu2O, –≤—Л—А–∞—Й–µ–љ–љ—Л—Е –Є–Ј —А–∞—Б—В–≤–Њ—А–∞, –Ї–∞–Ї —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–µ, —В–∞–Ї –Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≥—А–∞–љ–Є {100} –Є {111} –Љ–Њ–≥—Г—В –±—Л—В—М –ї–µ–≥–Ї–Њ –њ–Њ–ї—Г—З–µ–љ—Л –≤ –Ї–Њ–љ–µ—З–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ. –Э–∞ —А–Є—Б.2 –њ–Њ–Ї–∞–Ј–∞–љ–Њ —Г–њ–Њ—А—П–і–Њ—З–µ–љ–Є–µ –∞—В–Њ–Љ–Њ–≤ –≤–і–Њ–ї—М –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–µ–є —Б–Ї–Њ–ї–∞ (100) –Є (111). –Ш–Ј —А–Є—Б.2(–∞) –≤–Є–і–љ–Њ, —З—В–Њ –њ–ї–Њ—Б–Ї–Њ—Б—В—М (100) –Њ–±—А–∞–Ј–Њ–≤–∞–љ–∞ –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –∞—В–Њ–Љ–∞–Љ–Є –Љ–µ–і–Є, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ–ї–Њ—Б–Ї–Њ—Б—В—М (111) —Б–Њ—Б—В–Њ–Є—В –Ї–∞–Ї –Є–Ј –∞—В–Њ–Љ–Њ–≤ –Љ–µ–і–Є, —В–∞–Ї –Є –Є–Ј –∞—В–Њ–Љ–Њ–≤ –Ї–Є—Б–ї–Њ—А–Њ–і–∞, —А–Є—Б.2(–±). –Х—Б–ї–Є –≤ —Б–Є—Б—В–µ–Љ—Г –і–Њ–±–∞–≤–Є—В—М –≠–Ф–Ґ–Р, –µ–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л –±—Г–і—Г—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Б–≤—П–Ј—Л–≤–∞—В—М—Б—П —Б –∞—В–Њ–Љ–∞–Љ–Є –Љ–µ–і–Є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї—А–Є—Б—В–∞–ї–ї–∞ –љ–∞ –Њ–±–µ–Є—Е –≥—А–∞–љ—П—Е, (100) –Є (111). –Т—Б–ї–µ–і—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–Є—П –≤ —Б—В—А–Њ–µ–љ–Є–Є –Ї—А–Є—Б—В–∞–ї–ї–Є—З–µ—Б–Ї–Є—Е –њ–ї–Њ—Б–Ї–Њ—Б—В–µ–є, –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М (100) –±—Г–і–µ—В –њ–Њ–ї–љ–Њ—Б—В—М—О –њ–Њ–Ї—А—Л—В–∞ –Љ–Њ–ї–µ–Ї—Г–ї–∞–Љ–Є –≠–Ф–Ґ–Р, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М (111) –±—Г–і–µ—В –њ–Њ–Ї—А—Л—В–∞ –ї–Є—И—М —З–∞—Б—В–Є—З–љ–Њ. –Ш–љ—Л–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є –≤—Л—Б–Њ–Ї–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≠–Ф–Ґ–Р –Љ–Њ–ґ–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ–Њ–і–∞–≤–ї—П—В—М —А–Њ—Б—В –Ї—А–Є—Б—В–∞–ї–ї–∞ –≤–і–Њ–ї—М –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П [100]. –Я—А–Є –љ–Є–Ј–Ї–Њ–Љ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ–µ–і–Є –Є—Б—Е–Њ–і–љ–Њ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є –≠–Ф–Ґ–Р, —Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г—О—Й–Є–є —Н—Д—Д–µ–Ї—В –љ–∞ –≥—А–∞–љ—П—Е {100} –љ–µ –≤–µ–ї–Є–Ї –Є —А–∞—Б—В—Г—Й–Є–µ —З–∞—Б—В–Є—Ж—Л –Є–Љ–µ—О—В –Ї—Г–±–Є—З–µ—Б–Ї—Г—О —Д–Њ—А–Љ—Г, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞ —А–Є—Б.3(–∞-i). –Я—А–Є –≤—Л—Б–Њ–Ї–Њ–Љ –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є –≠–Ф–Ґ–Р, —Б–Ї–Њ—А–Њ—Б—В—М —А–Њ—Б—В–∞ –≥—А–∞–љ–Є {100} –њ–Њ—Б—В–Њ—П–љ–љ–∞, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Њ—Ж–µ—Б—Б –∞–і—Б–Њ—А–±—Ж–Є–Є-–і–µ—Б–Њ—А–±—Ж–Є–Є –≠–Ф–Ґ–Р –љ–∞ —Н—В–Њ–є –≥—А–∞–љ–Є –і–Њ—Б—В–Є–≥–∞–µ—В —А–∞–≤–љ–Њ–≤–µ—Б–Є—П. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Б–Ї–Њ—А–Њ—Б—В—М —А–Њ—Б—В–∞ –≥—А–∞–љ–Є {111} –≤—Б–µ –µ—Й–µ –Љ–Њ–ґ–µ—В –≤–∞—А—М–Є—А–Њ–≤–∞—В—М—Б—П –Ј–∞ —Б—З–µ—В –Њ–±–Њ—А–≤–∞–љ–љ—Л—Е —Б–≤—П–Ј–µ–є –љ–∞ –Ї–Є—Б–ї–Њ—А–Њ–і–µ. –Т —В–∞–Ї–Њ–Љ —Б–ї—Г—З–∞–µ –Є–Љ–µ–љ–љ–Њ –њ—А–Њ—Ж–µ—Б—Б —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –Ї–∞—В–Є–Њ–љ–Њ–≤ –Љ–µ–і–Є –Є–Ј —А–∞—Б—В–≤–Њ—А–∞ —Б –Ї–Є—Б–ї–Њ—А–Њ–і–Њ–Љ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ, –ї–Є–Љ–Є—В–Є—А—Г—О—Й–Є–Љ —Б–Ї–Њ—А–Њ—Б—В—М —А–Њ—Б—В–∞ –≥—А–∞–љ–Є {111}. –Ш–Ј–±—Л—В–Њ–Ї –≠–Ф–Ґ–Р –њ–Њ–љ–Є–ґ–∞–µ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є –Љ–µ–і–Є I –≤ —А–∞—Б—В–≤–Њ—А–µ –Ј–∞ —Б—З–µ—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ Cu(I)-–≠–Ф–Ґ–Р, —З—В–Њ –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–Љ—Г —Б–≤—П–Ј—Л–≤–∞–љ–Є—О –Љ–µ–і–Є I —Б –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–Љ–Є –∞—В–Њ–Љ–∞–Љ–Є –Ї–Є—Б–ї–Њ—А–Њ–і–∞. –Ъ–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ —Б–Ї–Њ—А–Њ—Б—В—М —А–Њ—Б—В–∞ –≥—А–∞–љ–Є {111} —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≠–Ф–Ґ–Р. –Э–∞ —А–Є—Б. 3(–∞) –њ–Њ–Ї–∞–Ј–∞–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–ї–Њ—Й–∞–і–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –≥—А–∞–љ–Є {100} –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–ї–Њ—Й–∞–і–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –≥—А–∞–љ–Є {111} –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≠–Ф–Ґ–Р. –Т–ї–Є—П–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≠–Ф–Ґ–Р –љ–∞ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—О –Ї—А–Є—Б—В–∞–ї–ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Њ–Є–ї–ї—О—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –≤ —А–∞–Љ–Ї–∞—Е –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Љ–Њ–і–µ–ї–Є, –Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–є –љ–∞ —А–∞—Б—З–µ—В–µ –≤–∞—А–Є–∞—Ж–Є–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–є —Н–љ–µ—А–≥–Є–Є –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї—А–Є—Б—В–∞–ї–ї–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –≥—А–∞–љ—П—Е. –≠—В–∞ –≤–µ–ї–Є—З–Є–љ–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞–Ї —А–∞–Ј–љ–Њ—Б—В—М —Н–љ–µ—А–≥–Є–Є —Б–≤—П–Ј–Є –і–ї—П –Њ–±—К–µ–Љ–љ—Л—Е –Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л—Е –∞—В–Њ–Љ–Њ–≤. –†–µ–Ј—Г–ї—М—В–∞—В –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –љ–∞ —А–Є—Б.4, –≥–і–µ R(100) –Є R(111) вАУ —Б–Ї–Њ—А–Њ—Б—В–Є —А–Њ—Б—В–∞ –≥—А–∞–љ–µ–є {100} –Є {111} —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –°–Њ–≥–ї–∞—Б–љ–Њ —А–∞—Б—З–µ—В–∞–Љ, –њ—А–Є –Љ–Њ–ї—М–љ–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≠–Ф–Ґ–Р/Cu(II) —А–∞–≤–љ–Њ–Љ 1 —Б–Ї–Њ—А–Њ—Б—В–Є —А–Њ—Б—В–∞ –≥—А–∞–љ–µ–є {100} –Є {111} —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –≤ 0,5-0,6 —А–∞–Ј, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Ї—Г–±–Є—З–µ—Б–Ї–Є—Е –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤. –Я—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≠–Ф–Ґ–Р —Б–Ї–Њ—А–Њ—Б—В—М —А–Њ—Б—В–∞ –≥—А–∞–љ–Є {100} –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≥—А–∞–љ–Є {111}, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О –µ–µ –њ–ї–Њ—Й–∞–і–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є. 2.2 –Ю–Ї—Б–Є–і —Ж–Є–љ–Ї–∞ –Ъ–∞–Ї –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞ –њ—А–Є–Љ–µ—А–µ Cu2O –њ–∞—Б—Б–Є–≤–∞—Ж–Є—П –Њ–і–љ–Њ–є (–Ї–∞—В–Є–Њ–љ–љ–Њ–є) –≥—А–∞–љ–Є –њ–Њ–ї—П—А–љ–Њ–≥–Њ –Ї—А–Є—Б—В–∞–ї–ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–Љ–µ–љ—П—В—М –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—О –Ї—А–Є—Б—В–∞–ї–ї–∞ –≤ —Е–Њ–і–µ —Б–Є–љ—В–µ–Ј–∞. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е —Б—В–∞–љ–Њ–≤–Є—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –њ–∞—Б—Б–Є–≤–Є—А–Њ–≤–∞—В—М –Њ–±–µ (–Ї–∞—В–Є–Њ–љ–љ—Г—О –Є –∞–љ–Є–Њ–љ–љ—Г—О) –њ–Њ–ї—П—А–љ—Л–µ –≥—А–∞–љ–Є, –µ—Й–µ –±–Њ–ї–µ–µ –Є–Ј–Љ–µ–љ—П—П —Б—В–µ–њ–µ–љ—М –∞–љ–Є–Ј–Њ—В—А–Њ–њ–Є–Є –≤–њ–ї–Њ—В—М –і–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –њ–ї–∞–љ–∞—А–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А. –Я—А–Є–Љ–µ—А–Њ–Љ —В–∞–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ —П–≤–ї—П–µ—В—Б—П —Б–Є–љ—В–µ–Ј ZnO –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Ю–Ї—Б–Є–і —Ж–Є–љ–Ї–∞ вАУ –≤–∞–ґ–љ—Л–є —Б –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –њ–Њ–ї—Г–њ—А–Њ–≤–Њ–і–љ–Є–Ї–Њ–≤—Л–є —И–Є—А–Њ–Ї–Њ–Ј–Њ–љ–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї, –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—Й–Є–є —А—П–і –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є –њ–Њ–ї–µ–Ј–љ—Л—Е —Б–≤–Њ–є—Б—В–≤, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –њ—М–µ–Ј–Њ—Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є–µ, —Б–Є–ї—М–љ–∞—П –љ–µ–ї–Є–љ–µ–є–љ–Њ—Б—В—М –≤–Њ–ї—М—В–∞–Љ–њ–µ—А–љ—Л—Е —Б–≤–Њ–є—Б—В–≤, –Ї–∞—В–∞–ї–Є—В–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В—М, –Њ–њ—В–Є—З–µ—Б–Ї–Њ–µ –њ–Њ–≥–ї–Њ—Й–µ–љ–Є–µ –Є –ї—О–Љ–Є–љ–µ—Б—Ж–µ–љ—Ж–Є—П. –Ъ–Є–љ–µ—В–Є–Ї—Г —А–Њ—Б—В–∞ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ ZnO –Љ–Њ–ґ–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —Ж–µ–ї—Л–Љ —А—П–і–Њ–Љ –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ —Б–Є—Б—В–µ–Љ—Л, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е —Г—А–Њ–≤–µ–љ—М —А–Э, —А–∞–Ј–ї–Є—З–љ—Л–µ –і–Њ–±–∞–≤–Ї–Є, —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї—М, —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —А–µ–∞–Ї—Ж–Є–Є. –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Б–≤—П–Ј—М –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є —З–∞—Б—В–Є—Ж —Б –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ —А–µ–ґ–Є–Љ–Њ–Љ —А–Њ—Б—В–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—К—П—Б–љ–µ–љ–∞ –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є–Љ–Є –љ–∞ –Ї–∞—В–Є–Њ–љ–љ–Њ–є (001) –Є –∞–љ–Є–Њ–љ–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—П—Е –Ї—А–Є—Б—В–∞–ї–ї–∞. –Т–ї–Є—П–љ–Є–µ –і–Њ–±–∞–≤–Њ–Ї –љ–∞ –Ї–Є–љ–µ—В–Є–Ї—Г —А–Њ—Б—В–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А–∞–љ–µ–є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—О –Ї—А–Є—Б—В–∞–ї–ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–∞ –њ—А–Є–Љ–µ—А–µ –њ–µ—А–µ–Ї–Є—Б–Є –≤–Њ–і–Њ—А–Њ–і–∞ H2O2 –Є —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л HAc. –Ш—Е –Є–Њ–љ—Л –Љ–Њ–≥—Г—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –Є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ –њ–∞—Б—Б–Є–≤–Є—А–Њ–≤–∞—В—М —В—Г –Є–ї–Є –Є–љ—Г—О –њ–Њ–ї—П—А–љ—Г—О –Ї—А–Є—Б—В–∞–ї–ї–Є—З–µ—Б–Ї—Г—О –≥—А–∞–љ—М. –Э–∞ —А–Є—Б.5 –њ–Њ–Ї–∞–Ј–∞–љ–Њ —Г–њ–Њ—А—П–і–Њ—З–µ–љ–Є–µ –∞—В–Њ–Љ–Њ–≤ –≤–і–Њ–ї—М –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–µ–є —Б–Ї–Њ–ї–∞ (001) –Є (001) . –Ш–Ј —А–Є—Б.5(–∞) –≤–Є–і–љ–Њ, —З—В–Њ –њ–ї–Њ—Б–Ї–Њ—Б—В—М (001) –Њ–±—А–∞–Ј–Њ–≤–∞–љ–∞ –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –∞—В–Њ–Љ–∞–Љ–Є —Ж–Є–љ–Ї–∞, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ–ї–Њ—Б–Ї–Њ—Б—В—М —Б–Њ—Б—В–Њ–Є—В —В–Њ–ї—М–Ї–Њ –Є–Ј –∞—В–Њ–Љ–Њ–≤ –Ї–Є—Б–ї–Њ—А–Њ–і–∞, —А–Є—Б.5(b). –Ф–Њ–±–∞–≤–ї–µ–љ–Є–µ –њ–µ—А–µ–Ї–Є—Б–Є –≤–Њ–і–Њ—А–Њ–і–∞ –њ–Њ–≤—Л—И–∞–µ—В —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —А–∞—Б—В–≤–Њ—А–µ–љ–љ–Њ–≥–Њ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –≤ —А–µ–∞–Ї—Ж–Є–Њ–љ–љ–Њ–є —Б–Љ–µ—Б–Є. –Я—А–Є —Н—В–Њ–Љ —А–∞–≤–љ–Њ–≤–µ—Б–Є–µ –њ–Њ–ї—Г—А–µ–∞–Ї—Ж–Є–Є O2 + 2H2O + 4e - → 4OH- —Б–Љ–µ—Й–∞–µ—В—Б—П –≤ —Б—В–Њ—А–Њ–љ—Г –њ—А–Њ–і—Г–Ї—В–∞. –Ш–Ј–±—Л—В–Њ–Ї –≥–Є–і—А–Њ–Ї—Б–Є–і –Є–Њ–љ–∞ OH-, –≤—Л–њ–Њ–ї–љ—П—О—Й–µ–≥–Њ —А–Њ–ї—М —Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ –∞–≥–µ–љ—В–∞, —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ —Б–≤—П–Ј—Л–≤–∞—П—Б—М —Б –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –Ј–∞—А—П–ґ–µ–љ–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М—О (100) –Є —Г–Љ–µ–љ—М—И–∞—П —Б–Ї–Њ—А–Њ—Б—В—М —А–Њ—Б—В–∞ –≤–і–Њ–ї—М –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П [001]. –≠—Д—Д–µ–Ї—В —В–∞–Ї–Њ–є –њ–∞—Б—Б–Є–≤–∞—Ж–Є–Є –њ—А–Њ–Є–ї–ї—О—Б—В—А–Є—А–Њ–≤–∞–љ –љ–∞ —А–Є—Б.6. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ–µ—А–µ–Ї–Є—Б–Є –≤–Њ–і–Њ—А–Њ–і–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї –±–Њ–ї–µ–µ –њ–Њ–ї–љ–Њ–є –њ–∞—Б—Б–Є–≤–∞—Ж–Є–Є –≥—А–∞–љ–Є (001) –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, —Г–≤–µ–ї–Є—З–µ–љ–Є—О –њ–ї–Њ—Й–∞–і–Є –µ–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ–љ—Г—Б–Њ–Њ–±—А–∞–Ј–љ–∞—П —Д–Њ—А–Љ–∞ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ —Б–Љ–µ–љ—П–µ—В—Б—П –≥–µ–Ї—Б–∞–≥–Њ–љ–∞–ї—М–љ—Л–Љ–Є —Ж–Є–ї–Є–љ–і—А–∞–Љ–Є. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–є —Н—Д—Д–µ–Ї—В —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–є –њ–∞—Б—Б–Є–≤–∞—Ж–Є–Є –≥—А–∞–љ–Є –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ –љ–∞ –њ—А–Є–Љ–µ—А–µ —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Ш–Ј–±—Л—В–Њ–Ї –њ—А–Њ—В–Њ–љ–Њ–≤ –≤ —А–∞—Б—В–≤–Њ—А–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –њ–∞—Б—Б–Є–≤–∞—Ж–Є–Є –љ–µ–≥–∞—В–Є–≤–љ–Њ –Ј–∞—А—П–ґ–µ–љ–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є . –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –∞–љ–Є–Њ–љ —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л —В–∞–Ї –ґ–µ –Љ–Њ–ґ–µ—В —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ –∞–і—Б–Њ—А–±–Є—А–Њ–≤–∞—В—М—Б—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є (001). –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —А–Њ—Б—В –Њ–±–µ–Є—Е –њ–Њ–ї—П—А–љ—Л—Е –≥—А–∞–љ–µ–є –Ј–∞—В—А—Г–і–љ–µ–љ –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є –Є–Ј–±—Л—В–Ї–∞ —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Я–Њ –Љ–µ—А–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –µ–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ї—А–Є—Б—В–∞–ї–ї—Л –њ—А–Є–Њ–±—А–µ—В–∞—О—В —Д–Њ—А–Љ—Г –Ї–Њ–љ—Г—Б–Њ–≤, –≥–µ–Ї—Б–∞–≥–Њ–љ–∞–ї—М–љ—Л—Е —Ж–Є–ї–Є–љ–і—А–Њ–≤ –Є —В–Њ–љ–Ї–Є—Е –і–Є—Б–Ї–Њ–≤, —З—В–Њ –њ—А–Њ–Є–ї–ї—О—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–∞ —А–Є—Б.7. –Р–љ–∞–ї–Њ–≥–Є—З–љ–Њ —Б–ї—Г—З–∞—О —А–Њ—Б—В–∞ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Њ–Ї—Б–Є–і–∞ –Љ–µ–і–Є (I) –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Њ–≤–µ–і–µ–љ–Њ –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –Ї–Є–љ–µ—В–Є–Ї–Є —А–Њ—Б—В–∞ –≤–і–Њ–ї—М –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–є (001) –Є (001). –Э–∞ —А–Є—Б.8 –њ–Њ–Ї–∞–Ј–∞–љ —А–µ–Ј—Г–ї—М—В–∞—В —В–∞–Ї–Њ–≥–Њ –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є–љ–≥–Є–±–Є—А—Г—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –°* –і–Њ–±–∞–≤–Ї–Є. 3 –•–Є–Љ–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –≤–ї–Є—П–љ–Є—П —Б—А–µ–і—Л –љ–∞ –Ї–Є–љ–µ—В–Є–Ї—Г —А–Њ—Б—В–∞ –°—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–Є–љ–µ—В–Є–Ї—Г —А–Њ—Б—В–∞ –Ї—А–Є—Б—В–∞–ї–ї–∞ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Б—А–µ–і–∞ –Є —Г—Б–ї–Њ–≤–Є—П, –≤ –Ї–Њ—В–Њ—А—Л—Е —Н—В–Њ—В –њ—А–Њ—Ж–µ—Б—Б –њ—А–Њ—В–µ–Ї–∞–µ—В. –Я–Њ–Љ–Є–Љ–Њ —В–∞–Ї–Є—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤, –Ї–∞–Ї —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞, –≤—П–Ј–Ї–Њ—Б—В—М –Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–µ –љ–∞—В—П–ґ–µ–љ–Є–µ —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї—П, –≤–ї–Є—П–љ–Є–µ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М—Б—П –Є —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—Г—В—П–Љ–Є. –•–Є–Љ–Є—З–µ—Б–Ї–Є –≤–ї–Є—П–љ–Є–µ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М—Б—П –Ї–∞–Ї —З–µ—А–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–µ–Ї—Г—А—Б–Њ—А–Њ–≤ –Є–ї–Є —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А–Њ–≤ –Ј–∞ —Б—З–µ—В –Є—Е —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є —Б –і–Њ–±–∞–≤–Ї–∞–Љ–Є, —В–∞–Ї –Є –Ј–∞ —Б—З–µ—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Б–∞–Љ–Њ–≥–Њ –Ї—А–Є—Б—В–∞–ї–ї–∞ —Б –і–Њ–±–∞–≤–Ї–∞–Љ–Є, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –≤ —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї–µ. 3.1 –Ъ–Њ–љ—В—А–Њ–ї—М –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А–∞ –њ—Г—В–µ–Љ –≤–≤–µ–і–µ–љ–Є—П –і–Њ–±–∞–≤–Њ–Ї –≤ —А–µ–∞–Ї—Ж–Є–Њ–љ–љ—Г—О —Б–Є—Б—В–µ–Љ—Г –Э–∞—А—П–і—Г —Б –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –≠–Ф–Ґ–Р, —Г—А–Њ–≤–µ–љ—М —А–Э —В–∞–Ї –ґ–µ –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —Н–≤–Њ–ї—О—Ж–Є–Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ Cu2O –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Љ–Њ–ґ–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Б–Љ–µ—Й–∞—В—М —А–∞–≤–љ–Њ–≤–µ—Б–Є–µ –≤ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —А–µ–∞–Ї—Ж–Є–Є Cu2+ + H2Y2 - ↔ CuY2- + 2H+ –≥–і–µ H2Y2 - - –Є–Њ–љ–љ–∞—П –Ј–∞–њ–Є—Б—М –≠–Ф–Ґ–Р –≤ —А–∞—Б—В–≤–Њ—А–µ. –Я—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Њ—Б–љ–Њ–≤–љ–Њ—Б—В–Є —А–∞—Б—В–≤–Њ—А–∞ —А–∞–≤–љ–Њ–≤–µ—Б–Є–µ —А–µ–∞–Ї—Ж–Є–Є –Љ–Њ–ґ–µ—В —Б–Љ–µ—Й–∞—В—М—Б—П –≤ —Б—В–Њ—А–Њ–љ—Г –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≠–Ф–Ґ–Р –≤ —А–∞—Б—В–≤–Њ—А–µ –њ–∞–і–∞–µ—В. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ Cu(I)-–≠–Ф–Ґ–Р —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П, –∞ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —Б–≤—П–Ј—Л–≤–∞–љ–Є—П Cu(I) —Б –∞—В–Њ–Љ–∞–Љ–Є –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –љ–∞ –≥—А–∞–љ—П—Е {111} –≤–Њ–Ј—А–∞—Б—В–∞–µ—В. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Э –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Б–Ї–Њ—А–Њ—Б—В–Є —А–Њ—Б—В–∞ –≥—А–∞–љ–µ–є {111}. –Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј —А–Є—Б.3(–∞-i)-3(c-i) –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —А–Э —А–∞—Б—В–≤–Њ—А–∞ –≥—А–∞–љ–Є {111} –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –њ–ї–Њ—Й–∞–і–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є. –Я—А–Є —Н—В–Њ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Ї–Њ—А–Њ—Б—В–Є —А–Њ—Б—В–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ —Б–Њ —Б–ї–Њ–ґ–љ–Њ–є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–µ–є, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞ —А–Є—Б.3(b-ii)-3(b-iii) –Є 3(c-ii)-3(c-iii). –Ґ–∞–Ї–Њ–є –ґ–µ –≤—Л–≤–Њ–і –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–і–µ–ї–∞–љ –Є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Љ–Њ–і–µ–ї–Є, –Њ–њ–Є—Б–∞–љ–љ–Њ–є –≤—Л—И–µ, —А–Є—Б.4. 3.2 –Ґ—А–∞–≤–ї–µ–љ–Є–µ –Ї—А–Є—Б—В–∞–ї–ї–∞ –≠—Д—Д–µ–Ї—В –і—А—Г–≥–Њ–≥–Њ —А–Њ–і–∞, —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ–Љ —Б–∞–Љ–Њ–≥–Њ –Ї—А–Є—Б—В–∞–ї–ї–∞ —Б –і–Њ–±–∞–≤–Ї–∞–Љ–Є, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –≤ —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї–µ, –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ –љ–∞ –њ—А–Є–Љ–µ—А–µ —А–Њ—Б—В–∞ –Љ–µ–Ј–Њ–њ–Њ—А–Є—Б—В—Л—Е –Љ–Є–Ї—А–Њ—Б—Д–µ—А –≥–µ–Љ–∞—В–Є—В–∞ α-Fe2O3 –њ–Њ –Љ–µ—В–Њ–і–Є–Ї–µ, –Њ–њ–Є—Б–∞–љ–љ–Њ–є –љ–Є–ґ–µ. –Т CH3COOK —Б–Є—Б—В–µ–Љ–µ –≥–Є–і—А–Њ–ї–Є–Ј Fe3+ –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Ї–Є—Б–ї–Њ–є —Б—А–µ–і—Л –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Я—А–Њ—Ж–µ—Б—Б—Л, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є–µ –≤ —Б–Є—Б—В–µ–Љ–µ, –Љ–Њ–≥—Г—В –±—Л—В—М –њ—А–Њ–Є–ї–ї—О—Б—В—А–Є—А–Њ–≤–∞–љ—Л —Б–ї–µ–і—Г—О—Й–Є–Љ–Є —А–µ–∞–Ї—Ж–Є—П–Љ–Є: CH3COO - + H2O ↔ CH3COOH + OH - Fe3+ + 3OH - → Fe(OH)3/FeOOH → (–≥–Є–і—А–Њ—В–µ—А–Љ–∞–ї—М–љ—Л–µ —Г—Б–ї–Њ–≤–Є—П) → α-Fe2O3 α-Fe2O3 + 6CH3COOH ↔ 2Fe3+ + 6CH3COO - + 3H2O –Я—А–Є—Б—Г—В—Б—В–≤–Є–µ —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ —Б—А–µ–і–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —З–∞—Б—В–Є—З–љ–Њ–Љ—Г —В—А–∞–≤–ї–µ–љ–Є—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –≥–µ–Љ–∞—В–Є—В–∞. –≠—В–Њ –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –њ–Њ–і–љ–Є–Љ–∞–µ—В —Б—В–µ–њ–µ–љ—М –њ–µ—А–µ—Б—Л—Й–µ–љ–Є—П —Б–Є—Б—В–µ–Љ—Л, –Ј–∞–њ—Г—Б–Ї–∞–µ—В—Б—П –њ—А–Њ—Ж–µ—Б—Б –≤—В–Њ—А–Є—З–љ–Њ–є –љ—Г–Ї–ї–µ–∞—Ж–Є–Є –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—П –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –Ї–Њ—А–µ–љ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ. –Ш–љ—В–µ—А–µ—Б–љ–Њ —Б—А–∞–≤–љ–µ–љ–Є–µ CH3COOK –Є NaOH —Б–Є—Б—В–µ–Љ (—А–Є—Б.9, —В–∞–±–ї.1). –Х—Б–ї–Є –≤ –њ–µ—А–≤–Њ–Љ —Б–ї—Г—З–∞–µ –њ—А–Њ—Ж–µ—Б—Б –≥–Є–і—А–Њ–ї–Є–Ј–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ —Б—А–µ–і–µ –Є –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–µ–є —В—А–∞–≤–ї–µ–љ–Є—П –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤, —В–Њ –≤–Њ –≤—В–Њ—А–Њ–Љ —Б–ї—Г—З–∞–µ —А–Э –њ–Њ–љ–Є–ґ–∞–µ—В—Б—П –ї–Є—И—М –і–Њ —Г—А–Њ–≤–љ—П –љ–µ–є—В—А–∞–ї—М–љ–Њ–є —Б—А–µ–і—Л –Є —В—А–∞–≤–ї–µ–љ–Є—П –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В. –Ю—В—Б—Г—В—Б—В–≤–Є–µ —Г—Б–ї–Њ–≤–Є–є –і–ї—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —В—А–∞–≤–ї–µ–љ–Є—П —З–∞—Б—В–Є—Ж –≥–µ–Љ–∞—В–Є—В–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —Б–њ–ї–Њ—И–љ—Л—Е –Љ–Є–Ї—А–Њ—Б—В—А—Г–Ї—В—Г—А –Ї—Г–±–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л (—А–Є—Б.10). –Т –µ—Й–µ –±–Њ–ї–µ–µ —Й–µ–ї–Њ—З–љ–Њ–є —Б—А–µ–і–µ (–Њ–±—А–∞–Ј–µ—Ж S-5) —Б–Њ–Ј–і–∞—О—В—Б—П —Г—Б–ї–Њ–≤–Є—П –і–ї—П —Б–Є–ї—М–љ–Њ –∞–љ–Є–Ј–Њ—В—А–Њ–њ–љ–Њ–≥–Њ —А–Њ—Б—В–∞ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ α-FeOOH –љ–∞ –њ–µ—А–≤–Њ–є —Б—В–∞–і–Є–Є —Б–Є–љ—В–µ–Ј–∞. –Я–Њ–Ј–і–љ–µ–µ –њ—А–Є –Њ—В–ґ–Є–≥–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Њ–і–љ–Њ–Љ–µ—А–љ—Л—Е –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ—А–Є—Б—В—Л—Е –љ–∞–љ–Њ–њ–∞–ї–Њ—З–µ–Ї α-Fe2O3. 4 –§–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –≤–ї–Є—П–љ–Є—П —Б—А–µ–і—Л –љ–∞ –Ї–Є–љ–µ—В–Є–Ї—Г —А–Њ—Б—В–∞ –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —А–∞–Ј–Љ–µ—А —З–∞—Б—В–Є—Ж –Ј–∞–≤–Є—Б–Є—В –Њ—В —Б–Ї–Њ—А–Њ—Б—В–Є –љ—Г–Ї–ї–µ–∞—Ж–Є–Є –Є —Б–Ї–Њ—А–Њ—Б—В–Є —А–Њ—Б—В–∞ —З–∞—Б—В–Є—Ж. –Э–µ–Љ–∞–ї–Њ–≤–∞–ґ–љ—Г—О —А–Њ–ї—М –љ–∞ —Н—В–Є –њ—А–Њ—Ж–µ—Б—Б—Л –Њ–Ї–∞–Ј—Л–≤–∞—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є —Б—А–µ–і—Л —А–Њ—Б—В–∞, —В–∞–Ї–Є–µ –Ї–∞–Ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–µ –љ–∞—В—П–ґ–µ–љ–Є–µ —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї—П –Є –≤—П–Ј–Ї–Њ—Б—В—М. 4.1 –Я–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–µ –љ–∞—В—П–ґ–µ–љ–Є–µ —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї—П –Я–Њ–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–є —Н–љ–µ—А–≥–Є–Є –љ–∞ –≥—А–∞–љ–Є—Ж–µ –Ї—А–Є—Б—В–∞–ї–ї/—А–∞—Б—В–≤–Њ—А–Є—В–µ–ї—М —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–Љ—Г –њ—А–Њ—В–µ–Ї–∞–љ–Є—О –Ј–∞—А–Њ–і—Л—И–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П. –≠—В–Њ —П–≤–ї–µ–љ–Є–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В, –љ–∞–њ—А–Є–Љ–µ—А, –њ–Њ–ї—Г—З–∞—В—М –Ї—А–Є—Б—В–∞–ї–ї—Л –≥–µ–Љ–∞—В–Є—В–∞ —Б –≤—Л—Б–Њ–Ї–Њ–є —Б—В–µ–њ–µ–љ—М—О –і–Є—Б–њ–µ—А—Б–љ–Њ—Б—В–Є. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –Є–Њ–љ–љ—Л–µ –ґ–Є–і–Ї–Њ—Б—В–Є –Є–Љ–µ—О—В –њ–Њ–ї—П—А–љ—Г—О –њ—А–Є—А–Њ–і—Г, –Њ–љ–Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–Љ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–Љ –љ–∞—В—П–ґ–µ–љ–Є–µ–Љ, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≤–Њ–і–Њ–є. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –≤ —В–∞–Ї–Њ–є —Б–Є—Б—В–µ–Љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М –њ–Њ–ї—Г—З–µ–љ—Л –Њ—З–µ–љ—М –Љ–∞–ї–µ–љ—М–Ї–Є–µ —З–∞—Б—В–Є—Ж—Л. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ї–∞—В–Є–Њ–љ—Л –Є–Њ–љ–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –Љ–Њ–≥—Г—В –∞–і—Б–Њ—А–±–Є—А–Њ–≤–∞—В—М—Б—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л—Е –∞—В–Њ–Љ–∞—Е –Ї–Є—Б–ї–Њ—А–Њ–і–∞, –Є—Б–њ–Њ–ї–љ—П—П —В–µ–Љ —Б–∞–Љ—Л–Љ —А–Њ–ї—М —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А–∞. –Я—А–Є —Н—В–Њ–Љ –љ–∞–ї–Є—З–Є–µ –і–∞–ґ–µ –љ–µ–±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ [bmim][Cl] –Љ–Њ–ґ–µ—В –њ—А–µ–њ—П—В—Б—В–≤–Њ–≤–∞—В—М –∞–≥–ї–Њ–Љ–µ—А–∞—Ж–Є–Є —З–∞—Б—В–Є—Ж –Є —Б–Њ—Е—А–∞–љ—П—В—М —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤—Л—Б–Њ–Ї—Г—О —Б—В–µ–њ–µ–љ—М –і–Є—Б–њ–µ—А—Б–љ–Њ—Б—В–Є —Б–Є—Б—В–µ–Љ—Л, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ —В–∞–±–ї–Є—Ж–µ 1. 4.2 –Т—П–Ј–Ї–Њ—Б—В—М —Б—А–µ–і—Л –Я—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –і–Њ–±–∞–≤–ї–µ–љ–љ–Њ–є –Є–Њ–љ–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –і–Є–∞–Љ–µ—В—А –Љ–µ–Ј–Њ–њ–Њ—А–Є—Б—В—Л—Е —Б—Д–µ—А –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –Њ—В 1 –і–Њ 2 –Љ–Ї–Љ (—В–∞–±–ї.1). –≠—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —Б –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –≤—П–Ј–Ї–Њ—Б—В–Є —Б—А–µ–і—Л. –Т —Б–Љ–µ—Б—П—Е –Є–Њ–љ–љ—Л—Е –ґ–Є–і–Ї–Њ—Б—В–µ–є —Б –≤–Њ–і–Њ–є –≤—П–Ј–Ї–Њ—Б—В—М —Н–Ї—Б–њ–Њ–љ–µ–љ—Ж–Є–∞–ї—М–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Љ–Њ–ї—М–љ–Њ–є –і–Њ–ї–Є –≤–Њ–і—Л. –Я—А–Є —Н—В–Њ–Љ –Ј–∞—В—А—Г–і–љ—П–µ—В—Б—П –і–Є—Д—Д—Г–Ј–Є—П –Љ–Њ–љ–Њ–Љ–µ—А–∞ –Ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї—А–Є—Б—В–∞–ї–ї–∞. –Т–ї–Є—П–љ–Є–µ —А–Њ—Б—В–∞ –≤—П–Ј–Ї–Њ—Б—В–Є –љ–∞ –њ—А–Њ—Ж–µ—Б—Б –Ю—Б—В–≤–∞–ї—М–і–Њ–≤—Б–Ї–Њ–≥–Њ —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ. –†–Њ—Б—В –љ–Њ–≤—Л—Е –Ј–∞—А–Њ–і—Л—И–µ–є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Г–ґ–µ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–µ–є —Б—Д–µ—А—Л –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –≥–Њ—А–∞–Ј–і–Њ –±–Њ–ї–µ–µ –≤–µ—А–Њ—П—В–љ—Л–Љ –љ–µ–ґ–µ–ї–Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –љ–Њ–≤–Њ–є –Љ–Є–Ї—А–Њ—Б—Д–µ—А—Л. –Ф—А—Г–≥–Є–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є —Н—Д—Д–µ–Ї—В –Ј–∞—В—А—Г–і–љ–µ–љ–љ–Њ–є –і–Є—Д—Д—Г–Ј–Є–Є –≤ –Є–Њ–љ–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –≤–Љ–µ—Б—В–µ —Б –ї–Њ–Ї–∞–ї—М–љ—Л–Љ –Ю—Б—В–≤–∞–ї—М–і–Њ–≤—Б–Ї–Є–Љ —Б–Њ–Ј—А–µ–≤–∞–љ–Є–µ–Љ –Ї—А–Є—В–Є—З–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤–ї–Є—П—О—В –љ–∞ —А–∞–Ј–Љ–µ—А –Љ–µ–Ј–Њ–њ–Њ—А–Є—Б—В—Л—Е –Љ–Є–Ї—А–Њ—Б—Д–µ—А. 5 –§–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Б–≤–µ—А—Е—Б—В—А—Г–Ї—В—Г—А –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–∞–Љ–µ–і–ї–µ–љ–Є—О —А–Њ—Б—В–∞ –љ–∞–љ–Њ–Ї—А–Є—Б—В–∞–ї–ї–∞ –Є –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є, –µ—Б–ї–Є —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А –∞–і—Б–Њ—А–±–Є—А—Г–µ—В—Б—П —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ. –Ю–і–љ–∞–Ї–Њ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –±–Њ–ї—М—И–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Љ–Њ–ї–µ–Ї—Г–ї —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А–∞ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —Б–≤–µ—А—Е—Б—В—А—Г–Ї—В—Г—А. –Ґ–∞–Ї –≤ –Љ–µ—В–Њ–і–Є–Ї–µ –њ–Њ–ї—Г—З–µ–љ–Є—П –Љ–µ–Ј–Њ–њ–Њ—А–Є—Б—В—Л—Е –Љ–Є–Ї—А–Њ—Б—Д–µ—А α-Fe2O3 —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є–Њ–љ–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –≤ —Б–Љ–µ—Б–Є –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —Б–≤–µ—А—Е—Б—В—А—Г–Ї—В—Г—А –љ–∞ –Њ—Б–љ–Њ–≤–µ –Є–Љ–µ—О—Й–Є—Е—Б—П –Љ–Њ–љ–Њ–і–Є—Б–њ–µ—А—Б–љ—Л—Е –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж (—А–Є—Б.11). –Ґ–∞–Ї–Њ–є –љ–µ–Њ–ґ–Є–і–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В, —Б–≤—П–Ј–∞–љ —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О —Б–∞–Љ–Њ—Г–њ–∞–Ї–Њ–≤–Ї–Є –Љ–Њ–ї–µ–Ї—Г–ї —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А–∞ –Ј–∞ —Б—З–µ—В π-π –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Љ–µ–ґ–і—Г –Ї–Њ–ї—М—Ж–∞–Љ–Є –Є–Љ–Є–і–∞–Ј–Њ–ї–Є—Г–Љ–∞. –Ь–µ—Е–∞–љ–Є–Ј–Љ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Љ–µ–Ј–Њ–њ–Њ—А–Є—Б—В—Л—Е –Љ–Є–Ї—А–Њ—Б—Д–µ—А –≥–µ–Љ–∞—В–Є—В–∞ —Б–ї–Њ–ґ–µ–љ –Є –≤–Ї–ї—О—З–∞–µ—В –≤ —Б–µ–±—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –Ю–±—А–∞–Ј—Г—О—Й–Є–µ—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –≥–Є–і—А–Њ–ї–Є–Ј–∞ —Е–ї–Њ—А–Є–і–∞ –ґ–µ–ї–µ–Ј–∞ –љ–∞–љ–Њ–Ї—А–Є—Б—В–∞–ї–ї—Л –≥–µ–Љ–∞—В–Є—В–∞ —А–∞–Ј–Љ–µ—А–Њ–Љ –Њ–Ї–Њ–ї–Њ 40 –љ–Љ –Є–Љ–µ—О—В –≤—Л—Б–Њ–Ї—Г—О —Б—В–µ–њ–µ–љ—М –Љ–Њ–љ–Њ–і–Є—Б–њ–µ—А—Б–љ–Њ—Б—В–Є –Є –њ–∞—Б—Б–Є–≤–Є—А–Њ–≤–∞–љ—Л –Љ–Њ–ї–µ–Ї—Г–ї–∞–Љ–Є [bmim][Cl]. –Ґ–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–∞–Љ–Њ—Г–њ–∞–Ї–Њ–≤–Ї–µ –Љ–Њ–ї–µ–Ї—Г–ї —Б—В–∞–±–Є–ї–Є–Ј–∞—В–Њ—А–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Ї—А—Г–њ–љ—Л—Е –њ–ї–Њ—В–љ—Л—Е —Б—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –љ–∞ –Њ—Б–љ–Њ–≤–µ –љ–∞–љ–Њ–Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –≥–µ–Љ–∞—В–Є—В–∞. –Ю–і–љ–∞–Ї–Њ –Є–Ј-–Ј–∞ –Њ–≥—А–Њ–Љ–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —В–∞–Ї–Є–µ –∞–≥—А–µ–≥–Є—А–Њ–≤–∞–љ–љ—Л–µ –Љ–Є–Ї—А–Њ—Б—В—А—Г–Ї—В—Г—А—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є –љ–µ —Г—Б—В–Њ–є—З–Є–≤—Л –Є –љ–∞—Е–Њ–і—П—В—Б—П –ї–Є—И—М –≤ –Љ–µ—В–∞—Б—В–∞–±–Є–ї—М–љ–Њ–Љ —А–∞–≤–љ–Њ–≤–µ—Б–Є–Є. –Т —В–Њ–ґ–µ –≤—А–µ–Љ—П —Г–њ–∞–≤—И–Є–є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –≥–Є–і—А–Њ–ї–Є–Ј–∞ —А–Э —А–∞—Б—В–≤–Њ—А–∞ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —З–∞—Б—В–Є—З–љ–Њ–Љ—Г —А–∞—Б—В–≤–Њ—А–µ–љ–Є—О –љ–∞–љ–Њ–Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –≥–µ–Љ–∞—В–Є—В–∞, –≤—Л–≤–Њ–і—П —В–µ–Љ —Б–∞–Љ—Л–Љ —Б–Є—Б—В–µ–Љ—Г –Є–Ј —Б–Њ—Б—В–Њ—П–љ–Є—П —А–∞–≤–љ–Њ–≤–µ—Б–Є—П. –Э–∞–Є–±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ–Њ –њ—А–Њ—Ж–µ—Б—Б —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –њ—А–Њ—В–µ–Ї–∞–µ—В –≤ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є —З–∞—Б—В–Є –∞–≥—А–µ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Б—В—А—Г–Ї—В—Г—А—Л. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Ж–µ–љ—В—А–∞–ї—М–љ–∞—П —З–∞—Б—В—М —Б—В–∞–љ–Њ–≤–Є—В—Б—П –∞–Љ–Њ—А—Д–љ–Њ–є, –∞ —Б—В–µ–њ–µ–љ—М –њ–µ—А–µ—Б—Л—Й–µ–љ–Є—П —Б–Є—Б—В–µ–Љ—Л –≤–Њ–Ј—А–∞—Б—В–∞–µ—В, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–∞—З–∞–ї—Г –≤—В–Њ—А–Є—З–љ–Њ–є –љ—Г–Ї–ї–µ–∞—Ж–Є–Є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ—Б—Д–µ—А. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —В–Њ–ї—Й–Є–љ–∞ –Ї—А–Є—Б—В–∞–ї–ї–Є—З–µ—Б–Ї–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Љ–Є–Ї—А–Њ—Б—Д–µ—А –≤–Њ–Ј—А–∞—Б—В–µ—В, –∞ –∞–Љ–Њ—А—Д–љ–Њ–µ —П–і—А–Њ —А–∞—Б—В–≤–Њ—А—П–µ—В—Б—П, —Д–Њ—А–Љ–Є—А—Г—П –њ–Њ–ї–Њ—Б—В—М –≤–љ—Г—В—А–Є –Љ–Є–Ї—А–Њ—Б—Д–µ—А—Л. –Т –Є—В–Њ–≥–µ –њ—А–Њ—Ж–µ—Б—Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Љ–µ–Ј–Њ–њ–Њ—А–Є—Б—В—Л—Е –Љ–Є–Ї—А–Њ—Б—Д–µ—А –≥–µ–Љ–∞—В–Є—В–∞ –≤–Ї–ї—О—З–∞–µ—В –≤ —Б–µ–±—П 3 —Б—В–∞–і–Є–Є (—А–Є—Б.12). –Э–∞ –њ–µ—А–≤–Њ–є —Б—В–∞–і–Є–Є –њ—А–Њ—В–µ–Ї–∞—О—В –њ—А–Њ—Ж–µ—Б—Б—Л —А–Њ—Б—В–∞ –Є –∞–≥—А–µ–≥–∞—Ж–Є–Є –љ–∞–љ–Њ–Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –≤ —Б—Д–µ—А–Є—З–µ—Б–Ї—Г—О –Љ–Є–Ї—А–Њ—Б—В—А—Г–Ї—В—Г—А—Г. –Э–∞ —Б–ї–µ–і—Г—О—Й–µ–є —Б—В–∞–і–Є–Є –і–Њ–Љ–Є–љ–Є—А—Г—О—В –њ—А–Њ—Ж–µ—Б—Б—Л —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –Є —А–µ–Ї—А–Є—Б—В–∞–ї–ї–Є–Ј–∞—Ж–Є–Є. –Э–∞ –њ–Њ—Б–ї–µ–і–љ–µ–є —Б—В–∞–і–Є–Є –њ—А–Њ—В–µ–Ї–∞–µ—В –њ—А–Њ—Ж–µ—Б—Б –Ю—Б—В–≤–∞–ї—М–і–Њ–≤—Б–Ї–Њ–≥–Њ —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П. –†–Њ–ї—М –Є–Њ–љ–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –њ—А–Є —Н—В–Њ–Љ —Б–≤–Њ–і–Є—В—Б—П –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —Б–≤–µ—А—Е—Б—В—А—Г–Ї—В—Г—А—Л –Є –Ј–∞—Й–Є—В–µ –≤–љ–µ—И–љ–µ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Љ–Є–Ї—А–Њ—Б—Д–µ—А—Л –Њ—В —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П. 6 –Ь–µ—В–Њ–і–Є–Ї–Є –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ Cu2O, ZnO, alfa-Fe2O3 6.1 –Ь–µ—В–Њ–і –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ Cu2O –Т —В–Є–њ–Є—З–љ–Њ–Љ —Б–Є–љ—В–µ–Ј–µ –Є—Б—Е–Њ–і–љ—Л–є —А–∞—Б—В–≤–Њ—А –њ–Њ–ї—Г—З–∞–ї–Є —Б–Љ–µ—И–µ–љ–Є–µ–Љ –≠–Ф–Ґ–Р (0.25 M) –Є Cu(NO)3 (0.5M).–Ь–Њ–ї—М–љ–Њ–µ –Њ—В–љ–Њ—И–µ–љ–Є–µ –≠–Ф–Ґ–Р/Cu(II) –≤–∞—А—М–Є—А–Њ–≤–∞–ї–Њ—Б—М –Њ—В 1 –і–Њ 2. –Ч–∞—В–µ–Љ –±—Л–ї –і–Њ–±–∞–≤–ї–µ–љ NaOH (1 M) –і–Њ –Ј–∞–і–∞–љ–љ–Њ–≥–Њ —А–Э (–Њ—В 9 13). –Я—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–є —А–∞—Б—В–≤–Њ—А –њ–µ—А–µ–≤–Њ–і–Є–ї–Є –≤ —Б—В–∞–ї—М–љ–Њ–є –∞–≤—В–Њ–Ї–ї–∞–≤ —Б —В–µ—Д–ї–Њ–љ–Њ–≤—Л–Љ –њ–Њ–Ї—А—Л—В–Є–µ–Љ. –†–µ–∞–Ї—Ж–Є—О –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ —В–µ—З–µ–љ–Є–µ 12 —З–∞—Б–Њ–≤ –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 110¬∞–° –Є –Ј–∞—В–µ–Љ –Њ—Е–ї–∞–ґ–і–∞–ї–Є –Њ–±—А–∞–Ј–µ—Ж –і–Њ –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л. –Ю–±—А–∞–Ј–µ—Ж –њ—А–Њ–Љ—Л–≤–∞–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є –Є –∞–±—Б–Њ–ї—О—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Н—В–Є–ї–Њ–≤—Л–Љ —Б–њ–Є—А—В–Њ–Љ. –Ъ–Њ–љ–µ—З–љ—Л–є –њ—А–Њ–і—Г–Ї—В —Б—Г—И–Є–ї–Є 6 —З–∞—Б–Њ–≤ –њ—А–Є 60¬∞–° [1]. 6.2 –Ь–µ—В–Њ–і –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ ZnO –¶–Є–љ–Ї–Њ–≤—Г—О —Д–Њ–ї—М–≥—Г –Њ—З–Є—Й–∞–ї–Є —Н—В–∞–љ–Њ–ї–Њ–Љ –Є –≤–Њ–і–Њ–є –≤ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–є –±–∞–љ–µ –і–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л —Г–і–∞–ї–Є—В—М –≤—Б–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–µ –Ј–∞–≥—А—П–Ј–љ–µ–љ–Є—П. 0.12 –≥ CuCl2¬Ј2H2O —А–∞—Б—В–≤–Њ—А—П–ї–Є –≤ 20 –Љ–ї –і–µ–Є–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –Ј–∞—В–µ–Љ –і–Њ–±–∞–≤–ї—П–ї–Є 0.2-2 –Љ–ї –њ–µ—А–µ–Ї–Є—Б–Є –≤–Њ–і–Њ—А–Њ–і–∞. –°–Љ–µ—Б—М –њ–µ—А–µ–≤–Њ–і–Є–ї–Є –≤ —Б—В–∞–ї—М–љ–Њ–є –∞–≤—В–Њ–Ї–ї–∞–≤ —Б —В–µ—Д–ї–Њ–љ–Њ–≤—Л–Љ –њ–Њ–Ї—А—Л—В–Є–µ–Љ –Є –і–Њ–±–∞–≤–ї—П–ї–Є –Њ—З–Є—Й–µ–љ–љ—Г—О —Ж–Є–љ–Ї–Њ–≤—Г—О —Д–Њ–ї—М–≥—Г. –†–µ–∞–Ї—Ж–Є—О –њ—А–Њ–≤–Њ–і–Є–ї–Є 8 —З–∞—Б–Њ–≤ –њ—А–Є 120¬∞–°. –Я—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–є –Њ–±—А–∞–Ј–µ—Ж –њ—А–Њ–Љ—Л–≤–∞–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј –і–µ–Є–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є –Є –≤—Л—Б—Г—И–Є–≤–∞–ї–Є –њ—А–Є 60¬∞–° –≤ —В–µ—З–µ–љ–Є–µ 6 —З–∞—Б–Њ–≤. –Я–∞—А–∞–ї–ї–µ–ї—М–љ–Њ –њ—А–Њ–≤–Њ–і–Є–ї–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В —Б –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ 0.2-0.5 –Љ–ї HAc –≤ –Є—Б—Е–Њ–і–љ—Л–є —А–∞—Б—В–≤–Њ—А. –Т –Њ–і–љ–Њ–Љ –Є–Ј —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ CuCl2¬Ј2H2O –±—Л–ї –Ј–∞–Љ–µ–љ–µ–љ –љ–∞ Cu(Ac)2 –і–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П [1]. 6.3 –Ь–µ—В–Њ–і –њ–Њ–ї—Г—З–µ–љ–Є—П –Љ–µ–Ј–Њ–њ–Њ—А–Є—Б—В—Л—Е –Љ–Є–Ї—А–Њ—Б—Д–µ—А α-Fe2O3 –≤ CH3COOK —Б–Є—Б—В–µ–Љ–µ 2 –Љ–Љ–Њ–ї—М FeCl3¬Ј6H2O –Є 6 –Љ–Љ–Њ–ї—М CH3COOK —А–∞—Б—В–≤–Њ—А—П–ї–Є –њ—А–Є –њ–µ—А–µ–Љ–µ—И–Є–≤–∞–љ–Є–Є –≤ 20 –Љ–ї –і–µ–Є–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –і–Њ –њ–Њ–ї—Г—З–µ–љ–Є—П –≥–Њ–Љ–Њ–≥–µ–љ–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞. –Ю–±—А–∞–Ј—Ж—Л S-0, S-1, S-2 –Є S-3 –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –і–Њ–±–∞–≤–ї–µ–љ–Є–Є 0, 1, 6 –Є 10 –Љ–Љ–Њ–ї—М –Є–Њ–љ–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є [bmim][Cl]. –Я–Њ—Б–ї–µ –њ–µ—А–µ–Љ–µ—И–Є–≤–∞–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ 20 –Љ–Є–љ—Г—В –≤–µ—Б—М –Њ–±—К–µ–Љ –њ–µ—А–µ–≤–Њ–і–Є–ї–Є –≤ —Б—В–∞–ї—М–љ–Њ–є –∞–≤—В–Њ–Ї–ї–∞–≤ —Б –µ–Љ–Ї–Њ—Б—В—М—О 30 –Љ–ї –Є –≥—А–µ–ї–Є 8 —З–∞—Б–Њ–≤ –њ—А–Є 150¬∞–°. –Я—А–Њ–і—Г–Ї—В –Њ—Е–ї–∞–ґ–і–∞–ї–Є –і–Њ –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –њ—А–Њ–Љ—Л–≤–∞–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј –і–µ–Є–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є –Є –±–µ–Ј–≤–Њ–і–љ—Л–Љ —Н—В–∞–љ–Њ–ї–Њ–Љ –і–Њ –љ–µ–є—В—А–∞–ї—М–љ–Њ–є —Б—А–µ–і—Л. –Ъ–Њ–љ–µ—З–љ—Л–є –њ—А–Њ–і—Г–Ї—В –Ї—А–∞—Б–љ–Њ–≥–Њ —Ж–≤–µ—В–∞ —Б—Г—И–Є–ї–Є –≤ –≤–∞–Ї—Г—Г–Љ–µ –њ—А–Є 80¬∞–° –≤ —В–µ—З–µ–љ–Є–µ 3 —З–∞—Б–Њ–≤. –Ь–Є–Ї—А–Њ–Ї—Г–±—Л α-Fe2O3 (–Њ–±—А–∞–Ј–µ—Ж S-4) –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –Ј–∞–Љ–µ–љ–µ CH3COOK –љ–∞ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ NaOH. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є–Њ–љ–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –њ—А–Є —Н—В–Њ–Љ —А–∞–≤–љ—П–ї–Њ—Б—М 6 –Љ–Љ–Њ–ї—М –Я–Њ—А–Є—Б—В—Л–µ –љ–∞–љ–Њ–њ–∞–ї–Њ—З–Ї–Є α-Fe2O3 (–Њ–±—А–∞–Ј–µ—Ж S-5) –њ–Њ–ї—Г—З–µ–љ—Л –≤ 2 —Б—В–∞–і–Є–Є. –Э–∞ –њ–µ—А–≤–Њ–Љ —Н—В–∞–њ–µ –≤ —Б–Є–ї—М–љ–Њ —Й–µ–ї–Њ—З–љ–Њ–є —Б—А–µ–і–µ (20 –Љ–Љ–Њ–ї—М NaOH) –њ–Њ–ї—Г—З–µ–љ—Л –љ–∞–љ–Њ–њ–∞–ї–Њ—З–Ї–Є α-FeOOH. –Ч–∞—В–µ–Љ –љ–∞–≥—А–µ–≤–∞–љ–Є–µ–Љ –љ–∞ –≤–Њ–Ј–і—Г—Е–µ –њ—А–Є 250¬∞–° –≤ —В–µ—З–µ–љ–Є–µ 3 —З–∞—Б–Њ–≤ –њ–Њ–ї—Г—З–µ–љ—Л –њ–Њ—А–Є—Б—В—Л–µ –љ–∞–љ–Њ–њ–∞–ї–Њ—З–Ї–Є α-Fe2O3 [2]. –°–њ–Є—Б–Њ–Ї –ї–Є—В–µ—А–∞—В—Г—А—Л [1] X.Zhao, X.Ren, C.Sun, X.Zhang, Yu.Si, C.Yan, J.Xu, D.Xue. Morphology Evolution at Nano - to Micro-Scale. Func.Mat.Lett., 2008, V.1, 3, 167-172. [2] J.Lian, X.Duan, J.Ma, P.Peng, T.Kim, W.Zheng. Hematite (α-Fe2O3) with Various Morphologies: Ionic Liquid-Assisted Synthesis, Formation Mechanism, and Properties. ACSNano, 2009, V.3, 11, 3749-3761. |