| –Э–∞–љ–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –≤ —В–Ї–∞–љ–µ–≤–Њ–є –Є–љ–ґ–µ–љ–µ—А–Є–Є | |
| –Э–∞–љ–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –≤ –Љ–µ–і–Є—Ж–Є–љ–µ - –°—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є |
|
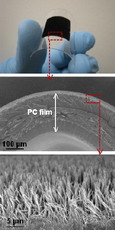
–°–Њ–Ј–і–∞–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є–Ј —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–∞—Ж–Є–µ–љ—В–∞ —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–Њ–є –Ј–∞–і–∞—З–µ–є —В–Ї–∞–љ–µ–≤–Њ–є –Є–љ–ґ–µ–љ–µ—А–Є–Є –Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –Є–љ—В–µ—А–µ—Б –і–ї—П –Љ–µ–і–Є—Ж–Є–љ—Л –Є –≤–µ—В–µ—А–Є–љ–∞—А–Є–Є. –Ю—Б–љ–Њ–≤–љ–∞—П –Є–і–µ—П –≥–µ–љ–µ—А–∞—Ж–Є–Є –љ–Њ–≤–Њ–є –Ї–Њ—Б—В–Є –њ—А–Њ—Б—В–∞. –Ш–Ј –±–Є–Њ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –і–µ–ї–∞—О—В –Ј–∞–≥–Њ—В–Њ–≤–Ї—Г, –Є–Љ–µ—О—Й—Г—О —Д–Њ—А–Љ—Г –±—Г–і—Г—Й–µ–є –Ї–Њ—Б—В–Є. –Т —Б–Є—Б—В–µ–Љ—Г –≤–љ–Њ—Б—П—В –Ї–ї–µ—В–Ї–Є-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ –≤—А–µ–Љ–µ–љ–µ–Љ –і–Њ–ї–ґ–љ—Л –Ј–∞—Б–µ–ї–Є—В—М –≤–µ—Б—М –Њ–±—К–µ–Љ –Ј–∞–≥–Њ—В–Њ–≤–Ї–Є. –І—В–Њ–±—Л –Ї–ї–µ—В–Ї–Є —А–Њ—Б–ї–Є –Є —А–∞–Ј–≤–Є–≤–∞–ї–Є—Б—М, –і–Њ–±–∞–≤–ї—П—О—В —Б–Є–≥–љ–∞–ї—М–љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л, —Д–∞–Ї—В–Њ—А—Л –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Є —А–Њ—Б—В–∞ –Ї–ї–µ—В–Њ–Ї –Ї–Њ—Б—В–Є. –Х—Б–ї–Є –≤—Б–µ —Г—Б–ї–Њ–≤–Є—П –њ–Њ–і–Њ–±—А–∞–љ—Л –њ—А–∞–≤–Є–ї—М–љ–Њ, —Б–Њ –≤—А–µ–Љ–µ–љ–µ–Љ –љ–∞ –Љ–µ—Б—В–µ –Ј–∞–≥–Њ—В–Њ–≤–Ї–Є –Њ–±—А–∞–Ј—Г–µ—В—Б—П –Ї–Њ—Б—В—М, –њ–Њ –њ—А–Њ—З–љ–Њ—Б—В–Є –Є –і—А—Г–≥–Є–Љ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ –Њ—З–µ–љ—М –њ–Њ—Е–Њ–ґ–∞—П –љ–∞ –љ–∞—Б—В–Њ—П—Й—Г—О . –Т –Ї–∞—З–µ—Б—В–≤–µ –Ї–ї–µ—В–Њ–Ї-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –Љ–µ–Ј–µ–љ—Е–Є–Љ–∞–ї—М–љ—Л–µ —Б—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є (mesenchymal stem cells, MSC), –Ї–Њ—В–Њ—А—Л–µ –љ–∞—Е–Њ–і—П—В—Б—П, –љ–∞–њ—А–Є–Љ–µ—А, –≤ –Ї–Њ—Б—В–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –Ї–∞–ґ–і–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞. –≠—В–Є –Ї–ї–µ—В–Ї–Є –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –Љ–Њ–≥—Г—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М—Б—П –≤ –Ї–ї–µ—В–Ї–Є —А–∞–Ј–љ—Л—Е —В–Є–њ–Њ–≤: –ґ–Є—А–Њ–≤—Л–µ, –Ї–Њ—Б—В–љ—Л–µ, —Е—А—П—Й–µ–≤—Л–µ, –Љ—Л—И—Ж—Л, –Ї–ї–µ—В–Ї–Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є. –Ф–ї—П –њ—А–∞–≤–Є–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—Б—В–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ, —З—В–Њ–±—Л MSC –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–ї–Є—Б—М –≤ –Њ—Б—В–µ–Њ–≥–µ–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —А–∞–Ј–Њ–≤—М—О—В—Б—П –≤ –Ј—А–µ–ї—Л–µ –Ї–ї–µ—В–Ї–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є вАУ –Њ—Б—В–µ–Њ–±–ї–∞—Б—В—Л –Є –Њ—Б—В–µ–Њ—Ж–Є—В—Л. –Ю–і–љ–∞–Ї–Њ –і–∞–ґ–µ —Г —В–∞–Ї–Њ–≥–Њ –Ј–∞–Љ–µ—З–∞—В–µ–ї—М–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Є–Љ–µ–µ—В—Б—П —А—П–і –љ–µ—А–µ—И–µ–љ–љ—Л—Е –њ—А–Њ–±–ї–µ–Љ. –Э–∞–њ—А–Є–Љ–µ—А, —Д–∞–Ї—В–Њ—А—Л, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ—Б—В–Є, –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –і–Њ–ї–ґ–љ—Л –њ–Њ–і–±–Є—А–∞—В—М—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ, —Б —Г—З–µ—В–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–∞, –њ–Њ–ї–∞ –Є —В.–њ. –Ф—А—Г–≥–∞—П —В—А—Г–і–љ–Њ—Б—В—М –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –Ј–∞—З–∞—Б—В—Г—О MSC —Д–Њ—А–Љ–Є—А—Г—О—В –≤–Њ–Ї—А—Г–≥ –Ј–∞–≥–Њ—В–Њ–≤–Ї–Є –Љ—П–≥–Ї–Є–µ —В–Ї–∞–љ–Є, –њ—А–µ–ґ–і–µ —З–µ–Љ —Г—Б–њ–µ—О—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М—Б—П –≤ –Ї–ї–µ—В–Ї–Є –Ї–Њ—Б—В–Є –Є –њ—А–Њ—А–∞—Б—В–Є –≤–љ—Г—В—А—М. –У—А—Г–њ–њ–∞ —Г—З–µ–љ—Л—Е –Є–Ј –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –Ј–∞–і—Г–Љ–∞–ї–∞—Б—М –љ–∞–і —В–µ–Љ, –Ї–∞–Ї –Ј–∞—Б—В–∞–≤–Є—В—М MSC –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М—Б—П –≤ –Ї–ї–µ—В–Ї–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –±–µ–Ј –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–∞ MSC in vitro –Ј–∞–≤–Є—Б–Є—В –Њ—В –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –њ–Њ–і–ї–Њ–ґ–Ї–Є, –љ–∞ –Ї–Њ—В–Њ—А–Њ–є –Њ–љ–Є —А–∞—Б—В—Г—В, –Њ–і–љ–∞–Ї–Њ —Г —А–∞–Ј–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –њ–Њ–ї—Г—З–∞–ї–Є—Б—М –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –Т —Ж–µ–ї–Њ–Љ —Б—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –±–Њ–ї–µ–µ —И–µ—А–Њ—Е–Њ–≤–∞—В–∞—П –њ–Њ–і–ї–Њ–ґ–Ї–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –ї—Г—З—И–µ–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–µ –Ї–ї–µ—В–Њ–Ї –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –Њ–і–љ–∞–Ї–Њ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –±—Л–≤–∞–µ—В –Є –љ–∞–Њ–±–Њ—А–Њ—В. –С—А–Є—В–∞–љ—Б–Ї–Є–µ —Г—З–µ–љ—Л–µ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є–ї–Є, —З—В–Њ –≤—Б–µ –і–µ–ї–Њ –≤ –љ–∞–љ–Њ—А–∞–Ј–Љ–µ—А–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П—Е —И–µ—А–Њ—Е–Њ–≤–∞—В–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є. –І—В–Њ–±—Л –њ—А–Њ–≤–µ—А–Є—В—М —Б–≤–Њ—О –і–Њ–≥–∞–і–Ї—Г, –Њ–љ–Є –Є–Ј–≥–Њ—В–Њ–≤–Є–ї–Є –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Љ–µ—В–Њ–і–∞ —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ-–ї—Г—З–µ–≤–Њ–є –ї–Є—В–Њ–≥—А–∞—Д–Є–Є (electron beam lithography, EBL) —А–∞–Ј–ї–Є—З–љ—Л–µ –њ–Њ–і–ї–Њ–ґ–Ї–Є –Є–Ј –њ–Њ–ї–Є–Љ–µ—В–Є–ї–Љ–µ—В–∞–Ї—А–Є–ї–∞—В–∞ (PMMA), –љ–∞ –Ї–Њ—В–Њ—А—Л—Е –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —А–∞—Б–њ–Њ–ї–∞–≥–∞–ї–Є—Б—М –ї—Г–љ–Ї–Є 120 –љ–Љ –≤ –і–Є–∞–Љ–µ—В—А–µ –Є 100 –љ–Љ –≥–ї—Г–±–Є–љ–Њ–є. –†–∞—Б—Б—В–Њ—П–љ–Є–µ –Љ–µ–ґ–і—Г –ї—Г–љ–Ї–∞–Љ–Є —Б–Њ—Б—В–∞–≤–ї—П–ї–Њ –≤ —Б—А–µ–і–љ–µ–Љ 300 –љ–Љ. –Я–Њ–Љ–Є–Љ–Њ –њ–Њ–і–ї–Њ–ґ–µ–Ї —Б —А–µ–≥—Г–ї—П—А–љ—Л–Љ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ–Љ –ї—Г–љ–Њ–Ї (–≤ –≤–µ—А—И–Є–љ–∞—Е —И–µ—Б—В–Є—Г–≥–Њ–ї—М–љ–Є–Ї–∞, HEX, –Є–ї–Є –Ї–≤–∞–і—А–∞—В–∞, SQ), –±—Л–ї–Є —В–∞–Ї–ґ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ—Л –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б —А–∞–Ј–љ–Њ–є —Б—В–µ–њ–µ–љ—М—О —А–∞–Ј—Г–њ–Њ—А—П–і–Њ—З–µ–љ–љ–Њ—Б—В–Є: –ї—Г–љ–Ї–Є —А–∞—Б–њ–Њ–ї–∞–≥–∞–ї–Є—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е 20 –љ–Љ –Њ—В –≤–µ—А—И–Є–љ –њ—А–∞–≤–Є–ї—М–љ—Л—Е –Ї–≤–∞–і—А–∞—В–Њ–≤ (DSQ20), –≤ –њ—А–µ–і–µ–ї–∞—Е 50 –љ–Љ (DSQ50) –Є–ї–Є –ґ–µ –±—Л–ї–Є –љ–∞–љ–µ—Б–µ–љ—Л —Б–ї—Г—З–∞–є–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ (RAND). –Т –њ–µ—А–≤–Њ–є —Б–µ—А–Є–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ –±—Л–ї–Њ –Є–Ј—Г—З–µ–љ–Њ –њ–Њ–≤–µ–і–µ–љ–Є–µ —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Є—Е –Њ—Б—В–µ–Њ–≥–µ–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –љ–∞ —В–∞–Ї–Є—Е –њ–Њ–і–ї–Њ–ґ–Ї–∞—Е in vitro. –І—В–Њ–±—Л –Њ—Ж–µ–љ–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ –Ї–Њ—Б—В–Є, –њ—А–µ–њ–∞—А–∞—В—Л –љ–∞ 21-–є –і–µ–љ—М –±—Л–ї–Є –Њ–±—А–∞–±–Њ—В–∞–љ—Л –∞–љ—В–Є—В–µ–ї–∞–Љ–Є –Ї –Њ—Б—В–µ–Њ–њ–Њ–љ—В–Є–љ—Г –Є –Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ—Г. –≠—В–Є –±–µ–ї–Ї–Є —П–≤–ї—П—О—В—Б—П —В–Ї–∞–љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–љ—Л–Љ–Є –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є –Ї–Њ—Б—В–Є. –†–µ–Ј—Г–ї—М—В–∞—В —В–∞–Ї–Њ–≥–Њ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2. –Ъ–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, –љ–∞ –њ–Њ–і–ї–Њ–ґ–Ї–µ —Б –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј—Г–њ–Њ—А—П–і–Њ—З–µ–љ–љ—Л–Љ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ–Љ –ї—Г–љ–Њ–Ї –Ї–ї–µ—В–Ї–Є –і–Њ—Б—В–Є–≥–∞—О—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Є –ї—Г—З—И–µ –≤—Б–µ–≥–Њ —Б–Є–љ—В–µ–Ј–Є—А—Г—О—В –Њ—Б—В–µ–Њ–њ–Њ–љ—В–Є–љ –Є –Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –≤ —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–∞—Е –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –Њ—Б—В—А–Њ–≤–Ї–Њ–≤ –Њ–Ї–Њ—Б—В–µ–љ–µ–љ–Є—П (bone nodule), —З—В–Њ —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ —Н—В–∞–њ–Њ–Љ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—Б—В–Є. –Ю–і–љ–∞–Ї–Њ –≥–Њ—А–∞–Ј–і–Њ –Є–љ—В–µ—А–µ—Б–љ–µ–µ –Ј–љ–∞—В—М, –Ї–∞–Ї –њ–Њ–≤–µ–і—Г—В —Б–µ–±—П –Љ–µ–Ј–µ–љ—Е–Є–Љ–∞–ї—М–љ—Л–µ —Б—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є –Є –±—Г–і—Г—В –ї–Є –Њ–љ–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М—Б—П –≤ –Њ—Б—В–µ–Њ–≥–µ–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є. –Я–Њ—Н—В–Њ–Љ—Г –≤ —Б–ї–µ–і—Г—О—Й–µ–є —Б–µ—А–Є–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –Є–Ј—Г—З–Є–ї–Є –≤–ї–Є—П–љ–Є–µ –љ–∞–љ–Њ—Б—В—А—Г–Ї—В—Г—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ–і–ї–Њ–ґ–µ–Ї –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ MSC. –Ъ–∞–Ї –Є –њ—А–µ–ґ–і–µ, –њ—А–µ–њ–∞—А–∞—В—Л –Њ–Ї—А–∞—И–Є–≤–∞–ї–Є –∞–љ—В–Є—В–µ–ї–∞–Љ–Є –Ї —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л–Љ –±–µ–ї–Ї–∞–Љ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ –Ї–Њ—Б—В–Є (–Њ—Б—В–µ–Њ–њ–Њ–љ—В–Є–љ—Г –Є –Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ—Г); –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є—Е –Њ–Ї—А–∞—Б–Є–ї–Є –∞–ї–Є–Ј–∞—А–Є–љ–Њ–Љ, —З—В–Њ–±—Л –њ—А–Њ—Б–ї–µ–і–Є—В—М –Ј–∞ –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Љ–∞—В—А–Є–Ї—Б–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 3. –°–љ–Њ–≤–∞ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –љ–∞–Є–ї—Г—З—И–µ–µ —А–∞–Ј–≤–Є—В–Є–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –љ–∞ –њ–Њ–і–ї–Њ–ґ–Ї–µ —Б —Г–≥–ї—Г–±–ї–µ–љ–Є—П–Љ–Є, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–Љ–Є –≤ –њ—А–µ–і–µ–ї–∞—Е 50 –љ–Љ –Њ—В –≤–µ—А—И–Є–љ –њ—А–∞–≤–Є–ї—М–љ—Л—Е –Ї–≤–∞–і—А–∞—В–Њ–≤. –£—З–µ–љ—Л–µ –љ–µ –Њ—Б—В–∞–љ–Њ–≤–Є–ї–Є—Б—М –љ–∞ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ–Љ. –Ф–ї—П –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–∞ –≤—Л–±—А–∞–љ–∞ –њ–Њ–і–ї–Њ–ґ–Ї–∞, –њ–Њ–Ї–∞–Ј–∞–≤—И–∞—П –љ–∞–Є–ї—Г—З—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤ –њ—А–µ–і—Л–і—Г—Й–Є—Е –Њ–њ—Л—В–∞—Е - DSQ50. –І—В–Њ–±—Л –Њ—Ж–µ–љ–Є—В—М, –љ–∞—Б–Ї–Њ–ї—М–Ї–Њ –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї –њ–Њ—Е–Њ–ґ–Є –љ–∞ –љ–∞—Б—В–Њ—П—Й—Г—О –Ї–Њ—Б—В–љ—Г—О —В–Ї–∞–љ—М, –±—Л–ї –Є–Ј—Г—З–µ–љ –њ—А–Њ—Д–Є–ї—М —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ —Н—В–Є—Е –Ї–ї–µ—В–Њ–Ї. –Т –Ї–∞—З–µ—Б—В–≤–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Ї–ї–µ—В–Ї–Є, –≤—Л—А–∞—Й–µ–љ–љ—Л–µ –љ–∞ —А–Њ–≤–љ–Њ–є –њ–Њ–і–ї–Њ–ґ–Ї–µ, –Њ–і–љ–∞–Ї–Њ –Њ–±—А–∞–±–Њ—В–∞–љ–љ—Л–µ –Є–љ–і—Г–Ї—В–Њ—А–Њ–Љ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є вАУ –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–Љ –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–Њ–Љ (DEX). –Я—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М, —З—В–Њ –њ—А–Є –Њ–±—А–∞–±–Њ—В–Ї–µ DEX –Ї–ї–µ—В–Ї–Є —Д–Њ—А–Љ–Є—А—Г—О—В –Ї–Њ—Б—В–љ—Г—О —В–Ї–∞–љ—М. –Т –Ї–∞—З–µ—Б—В–≤–µ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –≤–Ј—П–ї–Є –Ї–ї–µ—В–Ї–Є, –≤—Л—А–∞—Й–µ–љ–љ—Л–µ –љ–∞ —А–Њ–≤–љ–Њ–є –њ–Њ–і–ї–Њ–ґ–Ї–µ –±–µ–Ј –Ї–∞–Ї–Њ–є-–ї–Є–±–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Є. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –њ—А–Њ—Д–Є–ї—М —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ –і–Њ–≤–Њ–ї—М–љ–Њ –±–ї–Є–Ј–Њ–Ї –Ї –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ—Г –Ї–Њ–љ—В—А–Њ–ї—О, —Е–Њ—В—П –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і–µ—В–∞–ї—П—Е –Є –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –љ–µ–≥–Њ. –Ю–і–љ–∞–Ї–Њ –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ —З–∞—Б—В—М –Њ—В–ї–Є—З–Є–є –≤—Л–Ј–≤–∞–љ–∞ –≤–ї–Є—П–љ–Є–µ–Љ DEX –љ–∞ —Б—В–µ—А–Њ–Є–і–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –Є –љ–µ —Б–≤—П–Ј–∞–љ–∞ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ—А–Њ–і–µ–ї–∞–љ–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ —Г—З–µ–љ—Л–µ –Ј–∞–Ї–ї—О—З–∞—О—В, —З—В–Њ –љ–∞—И–ї–Є —Б–њ–Њ—Б–Њ–± –≤—Л—А–∞—Й–Є–≤–∞—В—М –Ї–ї–µ—В–Ї–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –±–µ–Ј –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є. –Э–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, —Н—В–Њ –≤–∞–ґ–љ—Л–є —И–∞–≥ –≤ –Њ–±–ї–∞—Б—В–Є —В–Ї–∞–љ–µ–≤–Њ–є –Є–љ–ґ–µ–љ–µ—А–Є–Є –Ї–Њ—Б—В–Є. |