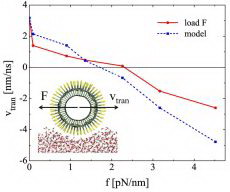
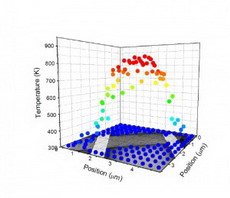
| –С–Њ–ї—М—И–Є–µ –љ–∞–і–µ–ґ–і—Л –љ–∞ –Љ–∞–ї–µ–љ—М–Ї–Є–µ —З–∞—Б—В–Є—Ж—Л | |
| –Э–Њ–≤–Њ—Б—В–Є –Є —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є - –Э–∞–љ–Њ–Љ–µ–і–Є—Ж–Є–љ–∞ |
|
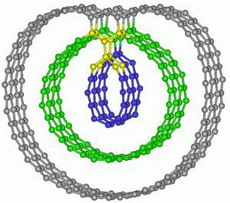
¬† –†–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–Њ–µ —Б –њ–Њ–Љ–Њ—Й—М—О –љ–∞–љ–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є–є —Б—А–µ–і—Б—В–≤–Њ –∞–і—А–µ—Б–љ–Њ–є –і–Њ—Б—В–∞–≤–Ї–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —А–∞–Ї–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Э–∞–љ–Њ—З–∞—Б—В–Є—Ж—Л, –њ–µ—А–µ–љ–Њ—Б—П—Й–Є–µ –і–≤–∞ –Є–ї–Є –±–Њ–ї–µ–µ –ї–µ–Ї–∞—А—Б—В–≤ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ, –Љ–Њ–≥—Г—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–Є—В—М —А–∞–Ї–Њ–≤—Г—О –Њ–њ—Г—Е–Њ–ї—М –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –µ–µ –Љ–µ—В–∞—Б—В–∞–Ј–Є—А–Њ–≤–∞–љ–Є–µ, —Г—В–≤–µ—А–ґ–і–∞—О—В —Г—З–µ–љ—Л–µ –Є–Ј Massachusetts General Hospital. –Ґ–∞–є—П–±–∞ –•–∞—Б–∞–љ (Tayyaba Hasan), –њ—А–Њ—Д–µ—Б—Б–Њ—А –і–µ—А–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –≤ –У–∞—А–≤–∞—А–і—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є —И–Ї–Њ–ї–µ (Harvard Medical School), –≤–Њ–Ј–≥–ї–∞–≤–ї—П–µ—В —А–∞–Ј—А–∞–±–Њ—В–Ї—Г –Є —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є–µ –і–≤—Г—Е ¬Ђ–љ–∞–љ–Њ—П—З–µ–µ–Ї¬ї (nanocells). –Э–∞–љ–Њ—П—З–µ–є–Ї–Є —Б–Њ—З–µ—В–∞—О—В —Б–≤–µ—В–Њ—В–µ—А–∞–њ–Є—О —Б –Љ–Њ–ї–µ–Ї—Г–ї–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–і–∞–≤–ї—П—О—В —А–Њ—Б—В —А–∞–Ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –Є–ї–Є –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤, –њ–Є—В–∞—О—Й–Є—Е –Њ–њ—Г—Е–Њ–ї—М. –•–Њ—В—П –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж—Л –њ–Њ–Ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–Є—Б—М —В–Њ–ї—М–Ї–Њ –љ–∞ –Љ—Л—И–∞—Е, —Б–Њ–Њ–±—Й–µ—Б—В–≤–Њ —Г—З–µ–љ—Л—Е, –Є–Ј—Г—З–∞—О—Й–Є—Е —А–∞–Ї, –≤–Њ—Б–њ—А–Є–љ—П–ї–Њ —А–∞–Ј—А–∞–±–Њ—В–Ї—Г —Б —Н–љ—В—Г–Ј–Є–∞–Ј–Љ–Њ–Љ. –†–∞–Ї –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Њ—Б—В–∞–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј —Б–∞–Љ—Л—Е —В—А—Г–і–љ–Њ–Є–Ј–ї–µ—З–Є–Љ—Л—Е —Д–Њ—А–Љ —А–∞–Ї–∞. –°–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –љ–µ–≥–Њ –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 30 –ї–µ—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є–Ј–Љ–µ–љ–Є–ї–∞—Б—М. –Я–Њ—Б–ї–µ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–ї—П–µ—В –њ–Њ–ї–≥–Њ–і–∞, –Є —В–Њ–ї—М–Ї–Њ –Љ–µ–љ–µ–µ 5 % –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ–ґ–Є–≤—Г—В –µ—Й–µ –њ—П—В—М –ї–µ—В. ¬Ђ–Ь—Л –Њ—З–µ–љ—М –Љ–∞–ї–Њ –Љ–Њ–ґ–µ–Љ —Б–і–µ–ї–∞—В—М –і–ї—П –±–Њ–ї—М–љ–Њ–≥–Њ, –µ—Б–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ —А–∞–Ї¬ї, вАУ –≥–Њ–≤–Њ—А–Є—В –Ъ—А–µ–є–≥ –Ґ–Њ–Љ–њ—Б–Њ–љ (Craig Thompson), –і–Є—А–µ–Ї—В–Њ—А Abramson Cancer Center –≤ –£–љ–Є–≤–µ—А—Б–Є—В–µ—В–µ –Я–µ–љ—Б–Є–ї—М–≤–∞–љ–Є–Є. –•–∞—Б–∞–љ –Є –і–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –Є–Ј –µ–µ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –≤–њ–µ—А–≤—Л–µ –њ—А–µ–і—Б—В–∞–≤–Є–ї–Є —Б–≤–Њ–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤ –љ–Њ—П–±—А–µ 2009 –≥–Њ–і–∞. –Ю–±—А–∞–Ј—Ж—Л –њ–µ—А–≤–Њ–≥–Њ —В–Є–њ–∞ –љ–∞–љ–Њ—П—З–µ–µ–Ї —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –±–Њ—А–Њ–ї–Є—Б—М —Б –Њ–њ—Г—Е–Њ–ї—П–Љ–Є, –ї–Є—И–∞—П –Є—Е –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П. –Ґ–≤–µ—А–і—Л–µ –њ–Њ–ї–Є–Љ–µ—А–љ—Л–µ –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж—Л —Б–Њ–і–µ—А–ґ–∞–ї–Є —Б–≤–µ—В–Њ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –Т–µ—А—В–µ–њ–Њ—А—Д–Є–љ (Verteporfin), –Ї–Њ—В–Њ—А—Л–є —Б–Њ–Ј–і–∞–µ—В —В–Њ–Ї—Б–Є—З–љ—Л–µ –∞–Ї—В–Є–≤–љ—Л–µ —Д–Њ—А–Љ—Л –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –њ—А–Є –Њ—Б–≤–µ—Й–µ–љ–Є–Є —Б–≤–µ—В–Њ–≤–Њ–є –≤–Њ–ї–љ–Њ–є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –і–ї–Є–љ—Л. –Ч–∞—В–µ–Љ —Н—В–Є –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж—Л –±—Л–ї–Є –Є–љ–Ї–∞–њ—Б—Г–ї–Є—А–Њ–≤–∞–љ—Л –≤ –ї–Є–њ–Є–і–љ—Л–µ –Ї–∞–њ—Б—Г–ї—Л –≤–Љ–µ—Б—В–µ —Б –С–µ–≤–∞—Ж–Є–Ј—Г–Љ–∞–±–Њ–Љ (Bevacizumab). –С–µ–≤–∞—Ж–Є–Ј—Г–Љ–∞–± вАУ –∞–љ—В–Є—В–µ–ї–∞, —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є –њ–Њ–і–∞–≤–ї—П—О—Й–Є–µ —А–Њ—Б—В –љ–Њ–≤—Л—Е –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤, –±–ї–Њ–Ї–Є—А—Г—П –±–µ–ї–Њ–Ї VEGF. –Т–µ—А—В–µ–њ–Њ—А—Д–Є–љ –Є –С–µ–≤–∞—Ж–Є–Ј—Г–Љ–∞–± —Г–ґ–µ –Њ–і–Њ–±—А–µ–љ—Л –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–є Food and Drug Administration. –С–µ–≤–∞—Ж–Є–Ј—Г–Љ–∞–± –њ—А–Є–Љ–µ–љ—П—О—В –і–ї—П –ї–µ—З–µ–љ–Є—П –Ї–Њ–ї–Њ—А–µ–Ї—В–∞–ї—М–љ–Њ–≥–Њ —А–∞–Ї–∞, —А–∞–Ї–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –ї–µ–≥–Ї–Є—Е, –њ–Њ—З–µ–Ї. –Х–≥–Њ –Ї–Њ–Љ–Љ–µ—А—З–µ—Б–Ї–Њ–µ –љ–∞–Ј–≤–∞–љ–Є–µ –Р–≤–∞—Б—В–Є–љ. –Т–µ—А—В–µ–њ–Њ—А—Д–Є–љ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –і–ї—П —Г–і–∞–ї–µ–љ–Є—П –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –њ—А–Є –Љ–∞–Ї—Г–ї—П—А–љ–Њ–є –і–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є. –Ю–љ –Є–Ј–≤–µ—Б—В–µ–љ –Ї–∞–Ї –Т–Є–Ј—Г–і–Є–љ. –Т –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е –љ–∞ –љ–µ–±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Т–µ—А—В–µ–њ–Њ—А—Д–Є–љ, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–є –Ї–∞–Ї –Љ–Њ–љ–Њ–њ—А–µ–њ–∞—А–∞—В, —Г–≤–µ–ї–Є—З–Є–≤–∞–ї —Б—А–µ–і–љ—О—О –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е —А–∞–Ї–Њ–Љ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —Б —И–µ—Б—В–Є –і–Њ –і–µ–≤—П—В–Є –Љ–µ—Б—П—Ж–µ–≤. –Ф–Њ–±–∞–≤–ї–µ–љ–Є–µ –Р–≤–∞—Б—В–Є–љ–∞ –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ–Њ—В–Њ–Љ—Г, —З—В–Њ –Њ–љ —А–∞–Ј—А—Г—И–∞–µ—В —Б–Њ—Б—Г–і—Л –Њ–њ—Г—Е–Њ–ї–Є, –Ј–∞—В—А—Г–і–љ—П—П –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –≤ –љ–µ–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Б–≤–µ—В–Њ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞. –Э–∞–њ—А–Њ—В–Є–≤, –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –љ–∞–љ–Њ—П—З–µ–µ–Ї –Њ–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ–њ–∞–і–∞–ї–Є –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ —А–∞–Ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є. –Ъ—А–Њ–≤–µ–љ–Њ—Б–љ—Л–µ —Б–Њ—Б—Г–і—Л –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –љ–µ–њ—А–Њ–љ–Є—Ж–∞–µ–Љ—Л –і–ї—П –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж, –љ–Њ —Б–Њ—Б—Г–і—Л –Њ–њ—Г—Е–Њ–ї–Є –Є–Љ–µ—О—В –≥–Њ—А–∞–Ј–і–Њ –±–Њ–ї–µ–µ –Ї—А—Г–њ–љ—Л–µ –њ–Њ—А—Л, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж–∞–Љ –њ—А–Њ—Е–Њ–і–Є—В—М —З–µ—А–µ–Ј –љ–Є—Е. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж—Л –љ–∞–Ї–∞–њ–ї–Є–≤–∞—О—В—Б—П –≤ –Њ–њ—Г—Е–Њ–ї–Є –Є –і–Њ—Б—В–∞–≤–ї—П—О—В –Ї —А–∞–Ї–Њ–≤—Л–Љ –Ї–ї–µ—В–Ї–∞–Љ –±–Њ–ї—М—И–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, —З–µ–Љ –Ї –Ї–ї–µ—В–Ї–∞–Љ –Ј–і–Њ—А–Њ–≤—Л—Е —В–Ї–∞–љ–µ–є. –≠—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–Њ–љ–Є–ґ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –і–Њ–Ј—Л –Њ–±–Њ–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г–Љ–µ–љ—М—И–Є—В—М –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л. –£—З–µ–љ—Л–µ –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–ї–Є –Ї–ї–µ—В–Ї–Є —А–∞–Ї–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —З–µ–ї–Њ–≤–µ–Ї–∞ –Љ—Л—И–∞–Љ –Є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –Њ–њ—Г—Е–Њ–ї–Є —А–∞—Б—В–Є. –Ч–∞—В–µ–Љ –Љ—Л—И–∞–Љ –≤–≤–µ–ї–Є —А–∞–Ј–Њ–≤—Г—О –і–Њ–Ј—Г –љ–∞–љ–Њ—П—З–µ–µ–Ї –Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞–ї–Є –љ–∞ –Њ–њ—Г—Е–Њ–ї—М –і–ї–Є–љ–љ–Њ–≤–Њ–ї–љ–Њ–≤—Л–Љ —Б–≤–µ—В–Њ–Љ. –Ь—Л—И–Є, –њ–Њ–ї—Г—З–Є–≤—И–Є–µ —В–∞–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ, –і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –±–Њ–ї—М—И–µ–µ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ —А–∞–Ј–Љ–µ—А–Њ–≤ –Њ–њ—Г—Е–Њ–ї–Є, —З–µ–Љ –Љ—Л—И–Є, –њ–Њ–ї—Г—З–Є–≤—И–Є–µ –Њ—В–і–µ–ї—М–љ–Њ –ї—О–±–Њ–є –Є–Ј –і–≤—Г—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ю–љ–Є —В–∞–Ї–ґ–µ –Є–Љ–µ–ї–Є, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ, –≤ –і–≤–∞ —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ –≤ –њ–µ—З–µ–љ–Є, –ї–µ–≥–Ї–Є—Е –Є –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–∞—Е. ¬Ђ–Ю—В–і–µ–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ —Н—В–Є—Е –і–≤—Г—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ —В–∞–Ї —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ, –Ї–∞–Ї –Є—Е —Б–Њ—З–µ—В–∞–љ–Є–µ –≤ –Њ–і–љ–Њ–є –љ–∞–љ–Њ–Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–Є¬ї, вАУ –Ј–∞–Ї–ї—О—З–∞–µ—В –•–∞—Б–∞–љ. –•–∞—Б–∞–љ —Б—З–Є—В–∞–µ—В, —З—В–Њ —Н—В–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–Њ—В–Њ–Љ—Г, —З—В–Њ –љ–∞–љ–Њ—П—З–µ–є–Ї–Є —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є —Б–ї–Є–≤–∞—О—В—Б—П —Б –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –Є –і–Њ—Б—В–∞–≤–ї—П—О—В –Р–≤–∞—Б—В–Є–љ –≤–љ—Г—В—А—М –Ї–ї–µ—В–Ї–Є. –Ш —Е–Њ—В—П –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –•–∞—Б–∞–љ –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М —В–Њ–Ї—Б–Є–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Њ–љ–∞ –љ–∞–і–µ–µ—В—Б—П, —З—В–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж –≤–љ—Г—В—А–Є –Њ–њ—Г—Е–Њ–ї–Є –Љ–Њ–ґ–µ—В —Г–Љ–µ–љ—М—И–Є—В—М –Њ–њ–∞—Б–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–µ–њ–∞—А–∞—В–∞. 30% –њ—А–Њ—Ж–µ–љ—В–Њ–≤ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –Р–≤–∞—Б—В–Є–љ, —Б—В—А–∞–і–∞—О—В –Њ—В –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ вАУ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤–Ї–ї—О—З–∞—П –Њ–њ–∞—Б–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ї—А–Њ–≤—П–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –Є–љ—Б—Г–ї—М—В–Њ–≤ –Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –®–Є–ї–∞–і–Є—В—М—П –°–µ–љ–≥—Г–њ—В–∞ (Shiladitya Sengupta), –і–Њ—Ж–µ–љ—В –Є–Ј –У–∞—А–≤–∞—А–і—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є —И–Ї–Њ–ї—Л, –љ–∞–Ј—Л–≤–∞–µ—В —А–µ–Ј—Г–ї—М—В–∞—В—Л —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ –љ–∞ –Љ—Л—И–∞—Е –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –•–∞—Б–∞–љ, –і—А–∞–Љ–∞—В–Є—З–љ—Л–Љ–Є. ¬Ђ–Я–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї —А–∞–Ї—Г –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В—Б—П –≤—Л–і–∞—О—Й–Є–Љ–Є—Б—П, —В–∞–Ї –Ї–∞–Ї –Ј–і–µ—Б—М –љ–µ—В –љ–Є–Ї–∞–Ї–Њ–є —В–µ—А–∞–њ–Є–Є¬ї, вАУ –≥–Њ–≤–Њ—А–Є—В –Њ–љ. –°–µ–љ–≥—Г–њ—В–∞ –љ–µ –њ—А–Є–љ–Є–Љ–∞–ї —Г—З–∞—Б—В–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –•–∞—Б–∞–љ, –љ–Њ –Є–і–µ—П –і–Њ—Б—В–∞–≤–Ї–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –њ–Њ–Љ–Њ—Й—М—О –љ–∞–љ–Њ—П—З–µ–µ–Ї –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –µ–Љ—Г. –Ю–љ —П–≤–ї—П–µ—В—Б—П —Б–Њ–Њ—Б–љ–Њ–≤–∞—В–µ–ї–µ–Љ Cerulean Pharma, –Ј–∞–љ–Є–Љ–∞—О—Й–µ–є—Б—П –Ї–Њ–Љ–Љ–µ—А—Ж–Є–∞–ї–Є–Ј–∞—Ж–Є–µ–є –њ—А–Њ–µ–Ї—В–∞ –љ–∞–љ–Њ—П—З–µ–µ–Ї –Є –і—А—Г–≥–Є—Е –љ–∞–љ–Њ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤ –і–Њ—Б—В–∞–≤–Ї–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Э–Њ —Б–ї–Њ–ґ–љ–Њ—Б—В—М –≤ —А–∞–Ј—А–∞–±–Њ—В–Ї–µ —В–∞–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –Њ–љ–Є –і–Њ–ї–ґ–љ—Л –±—Л—В—М –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –Њ–њ—В–Є–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –љ–Њ–≤–Њ–≥–Њ —Б–Њ—З–µ—В–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –У—А—Г–њ–њ–∞ –•–∞—Б–∞–љ —Г–ґ–µ —А–∞–Ј—А–∞–±–Њ—В–∞–ї–∞ –≤—В–Њ—А–Њ–є –≤–Є–і –љ–∞–љ–Њ—П—З–µ–µ–Ї вАУ –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –≤—Л—А–∞–±–Њ—В–Ї–Є –њ–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –Њ—З–µ–љ—М —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ —П–≤–ї–µ–љ–Є–µ–Љ. –£—З–µ–љ—Л–µ –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є, —З—В–Њ –і–≤–∞ –±–µ–ї–Ї–∞, EGFR –Є MET, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ—Л –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –Є —А–Њ—Б—В–∞ —А–∞–Ї–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞—Е —Б —А–∞–Ї–Њ–≤—Л–Љ–Є –Ї–ї–µ—В–Њ—З–љ—Л–Љ–Є –ї–Є–љ–Є—П–Љ–Є —Г—З–µ–љ—Л–µ —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є —Б–ї–µ–і—Г—О—Й—Г—О –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В—М: –µ—Б–ї–Є –Ј–∞–±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М –±–µ–ї–Њ–Ї EGFR, –Ї–ї–µ—В–Ї–Є —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –≤—Л—А–∞–±–Њ—В–Ї—Г –±–µ–ї–Ї–∞ MET, –Є –љ–∞–Њ–±–Њ—А–Њ—В. –Я–Њ—Н—В–Њ–Љ—Г –і–ї—П –ї—Г—З—И–µ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –љ–∞–і –Њ–њ—Г—Е–Њ–ї—М—О –•–∞—Б–∞–љ –њ—А–µ–і–ї–Њ–ґ–Є–ї–∞ –≤–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞—В—М –љ–∞ –Њ–±–∞ –±–µ–ї–Ї–∞ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ, –њ—А–Є–Љ–µ–љ—П—П –і–ї—П —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –і–ї–Є–љ–љ–Њ–≤–Њ–ї–љ–Њ–≤—Л–є —Б–≤–µ—В. –Т—В–Њ—А–Њ–є –≤–Є–і –љ–∞–љ–Њ—П—З–µ–µ–Ї —В—А–µ–±—Г–µ—В –±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ–Њ–≥–Њ –і–Є–Ј–∞–є–љ–∞. –£—З–µ–љ—Л–µ –љ–∞—З–∞–ї–Є —Б –Љ–∞–ї–µ–љ—М–Ї–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л PHA-66572, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–і–∞–≤–ї—П–µ—В –≤—Л—А–∞–±–Њ—В–Ї—Г –±–µ–ї–Ї–∞ MET, –њ–Њ–Љ–µ—Б—В–Є–≤ –µ–µ –≤ —В–Њ—В –ґ–µ –≤–Є–і –њ–Њ–ї–Є–Љ–µ—А–љ–Њ–є –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж—Л, –Ї–Њ—В–Њ—А–∞—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М –і–ї—П –њ–µ—А–≤–Њ–є —А–∞–Ј—А–∞–±–Њ—В–Ї–Є. –Ч–∞—В–µ–Љ –Њ–љ–Є –њ–Њ–Ї—А—Л–ї–Є –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж—Л –¶–µ—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ (Cetuximab), –∞–љ—В–Є—В–µ–ї–∞–Љ–Є, –±–ї–Њ–Ї–Є—А—Г—О—Й–Є–Љ–Є EGFR. –Э–∞ –Ї–Њ–љ–µ—З–љ–Њ–Љ —Н—В–∞–њ–µ –≤ –ї–Є–њ–Є–і–љ—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г, –Њ–Ї—А—Г–ґ–∞—О—Й—Г—О –њ–µ—А–≤—Л–µ –і–≤–∞ —Б–ї–Њ—П, —Г—З–µ–љ—Л–µ –≤–≤–µ–ї–Є –Т–Є–Ј—Г–і–Є–љ. –£ –Љ—Л—И–µ–є —Б –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є —А–∞–Ї–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–∞ —Б–і–µ–ї–∞–љ–∞ —А–∞–Ј–Њ–≤–∞—П –Є–љ—К–µ–Ї—Ж–Є—П –љ–∞–љ–Њ—П—З–µ–µ–Ї —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —Б–≤–µ—В–Њ—В–µ—А–∞–њ–Є–µ–є, –Њ–њ—Г—Е–Њ–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–Є—Б—М. –£—З–µ–љ—Л–µ –њ–Њ–Ї–∞ –њ—А–Њ–≤–µ—А—П—О—В, –Ї–∞–Ї–Њ–µ –≤–ї–Є—П–љ–Є–µ —В–∞–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –Љ–µ—В–∞—Б—В–∞–Ј–Є—А–Њ–≤–∞–љ–Є–µ, –љ–Њ —В–∞–Ї –Ї–∞–Ї –±–µ–ї–Њ–Ї MET –∞–Ї—В–Є–≤–µ–љ –≤ –Ї–ї–µ—В–Ї–∞—Е –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –≤–Є–і–Њ–≤ –Љ–µ—В–∞—Б—В–∞–Ј–Є—А—Г—О—Й–µ–≥–Њ —А–∞–Ї–∞, —Г—З–µ–љ—Л–µ –≤—Л—А–∞–ґ–∞—О—В –Њ–њ—В–Є–Љ–Є–Ј–Љ, —З—В–Њ –љ–∞–љ–Њ—П—З–µ–є–Ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–∞—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є —А–∞–Ј–Љ–µ—А –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤. –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є —Б—З–Є—В–∞—О—В —В–∞–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Б–Њ–±–µ–љ–љ–Њ –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є–Љ–Є –≤ —Б–≤—П–Ј–Є —Б –Њ—З–µ–≤–Є–і–љ—Л–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –§–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–∞—П —Д–Є—А–Љ–∞ Pfizer —А–∞–Ј—А–∞–±–Њ—В–∞–ї–∞ PHA-66572 —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –і–ї—П –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є—П –±–µ–ї–Ї–∞ MET –≤ —А–∞–Ї–Њ–≤—Л—Е –Ї–ї–µ—В–Ї–∞—Е, –љ–Њ –њ—А–µ–њ–∞—А–∞—В –Њ–Ї–∞–Ј–∞–ї—Б—П –љ–∞—Б—В–Њ–ї—М–Ї–Њ —В–Њ–Ї—Б–Є—З–љ—Л–Љ, —З—В–Њ –Ї–Њ–Љ–њ–∞–љ–Є—П –±—Л–ї–∞ –≤—Л–љ—Г–ґ–і–µ–љ–∞ –њ—А–µ–Ї—А–∞—В–Є—В—М –µ–≥–Њ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ. –Т –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ—Б—В—М —Н—В–Њ–Љ—Г –ґ–Є–≤–Њ—В–љ—Л–µ, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –љ–∞–љ–Њ—П—З–µ–є–Ї–Є, —Б–Њ—Е—А–∞–љ—П–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –љ–µ —В–µ—А—П–ї–Є –≤–µ—Б. –•–∞—Б–∞–љ –љ–∞–і–µ–µ—В—Б—П, —З—В–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б–њ—Л—В–∞–љ–Є—П –Њ–±–Њ–Є—Е –≤–Є–і–Њ–≤ –љ–∞–љ–Њ—П—З–µ–µ–Ї –љ–∞ –±–Њ–ї—М–љ—Л—Е —А–∞–Ї–Њ–Љ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –±—Г–і—Г—В –њ—А–Њ–≤–µ–і–µ–љ—Л –≤ –±–ї–Є–ґ–∞–є—И–Є–µ –≥–Њ–і—Л. –Ґ–∞–Ї –Ї–∞–Ї –Р–≤–∞—Б—В–Є–љ –Є –Т–Є–Ј—Г–і–Є–љ —Г–ґ–µ –Њ–і–Њ–±—А–µ–љ—Л FDA, –љ–∞–љ–Њ—П—З–µ–є–Ї–Є, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –Њ–±–∞ —Н—В–Є –њ—А–µ–њ–∞—А–∞—В–∞, –±—Г–і—Г—В –Є—Б–њ—Л—В–∞–љ—Л –њ–µ—А–≤—Л–Љ–Є, –Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Г–ґ–µ –≤ —В–µ—З–µ–љ–Є–µ —Б–ї–µ–і—Г—О—Й–µ–≥–Њ –≥–Њ–і–∞. –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Є–љ—Б—В–Є—В—Г—В —А–∞–Ї–∞ (National Cancer Institute) —Г–ґ–µ –њ—А–Њ–≤–Њ–і–Є—В —В–Њ–Ї—Б–Є–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —В–µ—Б—В—Л –љ–Њ–љ–∞—П—З–µ–µ–Ї, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Р–≤–∞—Б—В–Є–љ –Є –Т–Є–Ј—Г–і–Є–љ, –≤ —А–∞–Љ–Ї–∞—Е –Ј–∞—П–≤–Ї–Є –љ–∞ –Њ–і–Њ–±—А–µ–љ–Є–µ –Є—Е FDA. ¬Ђ–Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –Њ–љ–Є —Б–Ї–Њ—А–Њ –њ—А–Є–і—Г—В –≤ –Ї–ї–Є–љ–Є–Ї—Г¬ї, вАУ –≥–Њ–≤–Њ—А–Є—В –•–∞—Б–∞–љ. –Я—А–Њ–±–ї–µ–Љ–Њ–є –Њ—Б—В–∞–µ—В—Б—П –њ–Њ–Є—Б–Ї –ї—Г—З—И–Є—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ MET, –Є –Љ–љ–Њ–≥–Є–µ —Г—З–µ–љ—Л–µ —Г–ґ–µ —В–µ—Б—В–Є—А—Г—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Ї–∞–љ–і–Є–і–∞—В–Њ–≤. ¬† |